高三理科综合月考试题
理科综合
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分300分。考试时间150分种。
可能用的相对原子质量:H: 1 C: 12 O: 16 Na: 23
第Ⅰ卷(选择题 共126分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目涂写在答题卡上。
2.第小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案,不能答在试题卷上。
3.考试结束后,将Ⅱ卷和答题卡一并交回。
一、选择题:本题包括13个小题。每小题只有一个选项符合题意。
1、下列应用生物技术获得的成果中,依据基因重组进行的是 ( )
①1993年,以我国科学家侯云德院士为首的科研人员,成功地研制出我国第一个基因工程药品干扰素
②1996年7月,世界上第一只克隆羊“多利”诞生
③把抗癌细胞的单克隆抗体跟药物相结合,制成“生物导弹”注入患者体内,能在原位杀死癌细胞
④以杂交水稻之父——袁隆平院士为首的科研人员培育出超级杂交水稻
⑤杂交小麦之父——鲍文奎教授培育出适于高寒地区种植的小黑麦
A.①② B.③④ C.①④ D.①④⑤
2、右下图代表生物体内的三类生理过程。图中的X表示外界进入生物体的物质,Y表示生物体内产生的物质。在①②③生理过程中Y所代表的物质依次是( )
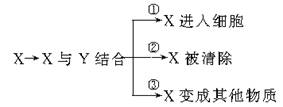
|
C.载体、酶、抗体 D.载体、抗体、酶
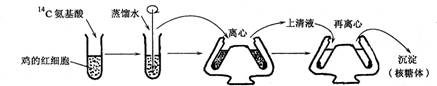 3、下图表示从血液中制备核糖体的大致过程,对该过程的叙述中,不合理的是( )
3、下图表示从血液中制备核糖体的大致过程,对该过程的叙述中,不合理的是( )
![]()
A.核糖体可以进行离体翻译生成蛋白质
B.步骤①加入含![]() C氨基酸的目的是为了在步骤⑤中检测核糖体
C氨基酸的目的是为了在步骤⑤中检测核糖体
C.步骤②的目的是破坏细胞膜,步骤③、④的目的是分离细胞器
D.该过程运用了渗透作用原理、同位素示踪法、离心法
4、鸡的输卵管细胞能合成卵清蛋白、红细胞能合成β-球蛋白、胰岛B细胞能合成胰岛素;用编码上述蛋白质的基因作探针,分别与从三种细胞中提取的总DNA(用三种限制酶将其切成片段)和总RNA进行杂交实验,结果如下表(“+”代表已杂交,“-”代表不能杂交):
| 细胞总DNA | 细胞总RNA | |||||
| 输卵管细胞 | 红细胞 | 胰岛细胞 | 输卵管细胞 | 红细胞 | 胰岛细胞 | |
| 卵清蛋白基因 | + | + | + | + | - | - |
| β-球蛋白基因 | + | + | + | - | + | - |
| 胰岛素基因 | + | + | + | - | - | + |
根据上述事实,下列叙述正确的是
A. 胰岛素细胞中只有胰岛素基因
B. 上述三种细胞的分化是由于细胞在发育过程中某些基因丢失所致
C. 在红细胞成熟过程中有选择性地表达了β-球蛋白基因
D. 在输卵管细胞中无β-球蛋白基因和胰岛素基因
5、对下列人类疾病的分析判断,不正确的是 ( )
|
A.在上述遗传病中,有一例是染色体异常遗传病
B.在上述病原微生物导致的疾病中,有一例是细菌感染引起的自身免疫病,还有一例是SARS病毒感染引起的疾病
C.在上述属内分泌腺功能障碍导致的疾病中,有关的内分泌腺是肝脏和甲状腺
D.在上述的免疫功能失调疾病中,有一例是二次免疫引起的病疾
6.已知:⑴胆矾失水的热化学反应方程式为:
CuSO4·5H2O(s)=CuSO4(s)+5H2O(l);△H=+Q1kJ/mol
⑵室温下,无水硫酸铜溶于水的热化学方程式为:
CuSO4(s)= Cu2+(aq)+SO42-(aq);△H=-Q2kJ/mol
⑶胆矾(CuSO4·5H2O)溶于水时,溶液温度降低。
则Q1与Q2的关系是(Q1、Q2为正数)
A.Q1>Q2 B.Q1=Q2 C.Q1<Q2 D.无法确定
7、下列离子方程式的书写中,正确的是:
A、等体积等物质的量浓度的氢氧化钡溶液与明矾溶液混和:
![]()
B、小苏打水溶液与盐酸反应:![]()
C、用Na2C03溶液吸收少量S02:![]()
D、Fe203固体溶于氢碘酸溶液:![]()
8、设NA表示阿伏加德罗常数,下列叙述中正确的是:
A、53gNa2C03固体含有的离子数为1.5NA
B、铁、铜和稀硫酸构成原电池,当转移NA个电子时,产生的气体体积一定为11.2L
C、12g金刚石中所含的C—C键数为NA
D、标准状况下0.5NA个Br2所占的体积约为11.2L
|

下列反应中全部符合上述图像的反应是
A.N2(g)+3H2(g) ![]() 2NH3(g);△H=-Q1kJ/mol(Q1>0)
2NH3(g);△H=-Q1kJ/mol(Q1>0)
B.
2SO2(g)+O2(g)![]() 2SO3(g);△H=─Q2 kJ/mol(Q2>0)
2SO3(g);△H=─Q2 kJ/mol(Q2>0)
C.4NH3(g)+5O2(g) ![]() 4NO+6H2O(g);△H=-808.7 kJ/mol
4NO+6H2O(g);△H=-808.7 kJ/mol
D.C(s)+CO2(g) ![]() 2CO(g);△H=+171.4kJ/mol
2CO(g);△H=+171.4kJ/mol
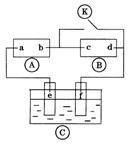 10.下图
10.下图![]() 为直流电源,
为直流电源,![]() 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸,
![]() 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现![]() 上的c点显红色.为实现铁上镀
上的c点显红色.为实现铁上镀
锌,接通![]() 后,使c、d两点短路.下列叙述正确的是( )
后,使c、d两点短路.下列叙述正确的是( )
A.a为直流电源的负极
B.c极发生的反应为2H++2e-=H2↑
C.f电极为锌板
D.e极发生还原反应
11.分子式为C4H8O3的有机物A,在一定条件具有如下性质:①在浓硫酸存在下,能脱水生成唯一的有机物B,B能使溴的四氯化碳溶液褪色;②在浓硫酸的作用下,A能分别与丙酸和乙醇反应生成C和D;③在浓硫酸的的下,能生成一种分子式为C4H6O2的五元环状化合物E。下列叙述正确的是
A.A的结构简式为CH3CH=CH(OH)COOH
B.B的结构简式为HOCH2CH2CH2COOH
C.A转化为B的反应属于取代反应
 D.B与E互为同系物,C与D互为同分异构体
D.B与E互为同系物,C与D互为同分异构体
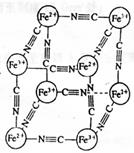
12.分析化学中常用X射线研究晶体结构,有一种蓝色晶体[可表示为:
MxFey(CN)z],研究表明它的结构特性是:Fe2+和Fe3+分别占据立方
体的顶点,自身互不相邻,而CN—位于立方体的棱上。其晶体中的
阴离子晶胞结构如图示,下列说法不正确的是
|
B.M的离子位于上述晶胞面心,呈+2价
C.M的离子位于上述晶胞体心,呈+1价,且M+空缺率为50%(体心中没有M+占总体心的百分比)
D.晶体的化学式可表示为MFe2(CN)6,且M为+1价
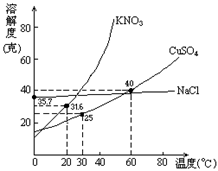 13.右图是几种盐的溶解度曲线.下列说法正确的是
13.右图是几种盐的溶解度曲线.下列说法正确的是
A.40℃时,将35克食盐溶于100克水中,降温
至0℃时,可析出氯化钠晶体
B.20℃时,硝酸钾饱和溶液的质量百分比浓
度是31.6%
C.60℃时,200克水中溶解80克硫酸铜达饱和.当降温至 30℃时,可析出30克硫酸铜晶体
D.30℃时,将35克硝酸钾和35克食盐同时溶于100克水中,蒸发时,先析出的是氯化钠
二、选择题:本题包括8个小题。每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确。
14、使某种金属发生光电效应所需的光子的最小能量为2.60eV。已知一群氢原子处于量子数n=4的激发态,如图所示。这些氢原子能够自发地跃迁到较低的能量状态,并向外辐射多种频率的光。若用这些氢原子辐射的光照射这种金属,能够使这种金属发生光电效应的有几种频率的光( )
A.一种 B.二种 C.三种 D.四种

15、下列几种说法,正确的是 ( )
A.布朗运动就是液体分子的热运动,液体温度越高,其分子的平均动能越大
B.一定质量的理想气体,温度降低而压强增大,则其密度变小
C.随分子间距增大,分子间引力和斥力均减小,分子势能一定减小
D.第二类永动机不违反能量守恒定律,但违反了热力学第二定律
16、下列有关光现象或应用的说法正确的是 ( )
|
B、CD光盘表面出现的彩色条纹是光的干涉现象造成的
C、阳光下茂密的树荫中,地面上出现的圆形亮斑是光的衍射产生的
D、无影灯并不是没有影子的灯
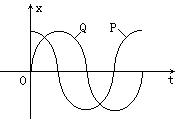 17、在波的传播方向上有两个质点P和Q,并且波由P向Q传播.它们的平衡位置相距s=1.2m,且小于一个波长,此波的传播速度为 v=2m/s.P和Q的振动图线如图所示,则波的振动周期为 ( )
17、在波的传播方向上有两个质点P和Q,并且波由P向Q传播.它们的平衡位置相距s=1.2m,且小于一个波长,此波的传播速度为 v=2m/s.P和Q的振动图线如图所示,则波的振动周期为 ( )
A、0.6s B、1.2s
C、2.4s D、4.8s
18、土星外层上有一个环.为了判断它是土星的一部分还是土星的卫星群,可以测量环中各层的线速度V与该层到土星中心的距离R之间的关系来判断。正确的判断是( )
(1)若V ∝R,则该层是土星的一部分. (2)若V2 ∝R,则该层是土星的卫星群.
(3)若V ∝![]() ,则该层是土星的一部分.(4)若V2∝
,则该层是土星的一部分.(4)若V2∝![]() ,则该层是土星的卫星群.
,则该层是土星的卫星群.
A、(1)(3)正确; B、(2)(4)正确;
C、(1)(4)正确; D、(3)(4)正确;
19、如图所示,Q1和Q2是在真空中固定的两个等量同种点电荷,O点为两电荷连线的中点,A和B是连线上关于中点O对称的两点。一电子从A点由静止开始运动,运动中仅受电场力作用,此电子将以O为中心在A、B之间来回往复运动。对于这一现象下面说法中正确的是 ( )
![]()
A.Q1和Q2都带正电
B.电子在O点的速度最大
C.电子在A、B之间所受电场力大小不变
D.电子在A、B之间运动过程机械能守恒
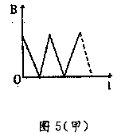
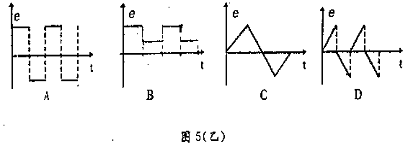
20、一闭合导线环垂直置于匀强磁场中,若磁感强度随时间变化如图5(甲)所示,则环中的感应电动势变化情况是图5(乙)中的哪一个 ( )
|
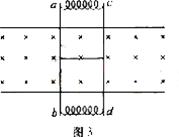 21、如图3所示,两根足够长的固定平行金属光滑导轨位于同一水平面,导轨上横放着两根相同的导体棒ab、cd与导轨构成矩形回路。导体棒的两端连接着处于压缩状态的两根轻质弹簧,两棒的中间用细线绑住,它们的电阻均为R,回路上其余部分的电阻不计。在导轨平面内两导轨间有一竖直向下的匀强磁场。开始时,导体棒处于静止状态,剪断细线后,导体棒运动过程中 ( )
21、如图3所示,两根足够长的固定平行金属光滑导轨位于同一水平面,导轨上横放着两根相同的导体棒ab、cd与导轨构成矩形回路。导体棒的两端连接着处于压缩状态的两根轻质弹簧,两棒的中间用细线绑住,它们的电阻均为R,回路上其余部分的电阻不计。在导轨平面内两导轨间有一竖直向下的匀强磁场。开始时,导体棒处于静止状态,剪断细线后,导体棒运动过程中 ( )
A.回路中有感应电动势
B.两根导体棒所受安培力的方向相同
C.两根导体棒和弹簧构成的系统动量守恒,机械能守恒
D.两根导体棒和弹簧构成的系统动量守恒,机械能不守恒
|
高三理科综合月考试题
注意事项:
1.第Ⅱ卷共页,用钢笔或圆珠笔直接答在试题卷上。
2.答题前将密封线内的项目填写清楚。
| 题号 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 总分 |
| 分数 |
第Ⅱ卷(非选择题 共174分)
| 得 分 | 评卷人 |
22、(18分)
(1)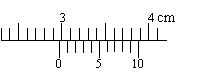 用游标为10分度的游标卡尺测量某金属球的直径,结果如下图所示,由图可知金属球的直径为
cm。(4分)
用游标为10分度的游标卡尺测量某金属球的直径,结果如下图所示,由图可知金属球的直径为
cm。(4分)
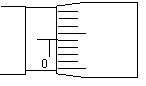
(2)在“测量金属丝的电阻率”的实验中:
用螺旋测微器测金属丝的直径如右图所示,则该金属丝的直径为 mm。(4分)
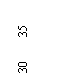
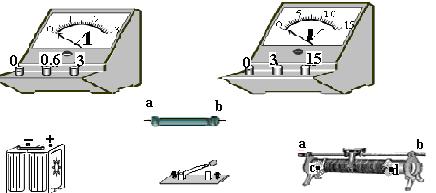
 (3)已知电阻丝的电阻约为10Ω,现备有下列器材供测量该电阻丝的电阻时选用,应选用的器材是
(只填代号)(5分)
(3)已知电阻丝的电阻约为10Ω,现备有下列器材供测量该电阻丝的电阻时选用,应选用的器材是
(只填代号)(5分)
A.量程0~0.6A,内阻为0.5Ω的电流表;
B.量程0~3A,内阻为0.1Ω的电流表;
C.量程0~3V,内阻为6kΩ的电压表;
D.量程0~15V,内阻为30kΩ的电压表;
E.阻值为0~1kΩ,额定电流为0.5A的滑动变阻器;
F.阻值为0~10Ω,额定电流为2A的滑动变阻器;
G.蓄电池(6V)
H.开关一个,导线若干。
(4)若下图所示的实验仪器就是我们选定的,请用铅笔画线连好电路。(5分)
|
| 得 分 | 评卷人 |
23、(16分)
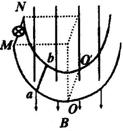 如图所示:半径为r、电阻不计的两个半圆形光滑导轨并列竖直放置,在轨道左方端点M、N是接有阻值为R的小电珠,整个轨道处在磁感应强度为B的匀强磁场中,两导轨间距离为L,现有一质量为m,电阻也是R的金属棒ab从M、N处由静止释放,经一定时间到达导轨最低点O、O′,此时速度为v .(1)指出金属棒ab从M、N到O、O′的过程中,通过小电珠的电流方向和金属棒ab的速度大小变化情况。(2)求金属棒ab到达O、O′时,整个电路的瞬时电功率。(3)求金属棒ab从M、N到O、O′的过程中,小电珠上产生的热量。
如图所示:半径为r、电阻不计的两个半圆形光滑导轨并列竖直放置,在轨道左方端点M、N是接有阻值为R的小电珠,整个轨道处在磁感应强度为B的匀强磁场中,两导轨间距离为L,现有一质量为m,电阻也是R的金属棒ab从M、N处由静止释放,经一定时间到达导轨最低点O、O′,此时速度为v .(1)指出金属棒ab从M、N到O、O′的过程中,通过小电珠的电流方向和金属棒ab的速度大小变化情况。(2)求金属棒ab到达O、O′时,整个电路的瞬时电功率。(3)求金属棒ab从M、N到O、O′的过程中,小电珠上产生的热量。
| 得 分 | 评卷人 |
24、(18分)
一个宇航员在某星球表面想要估测该星球的质量,她用一根细线拴住一个质量为m的小球,做成一个摆长为L的单摆,测的该单摆在竖直平面内作小角度摆动时,t时间完成了N次全振动,已知该星球的半径为R,万有引力常数为G,求:(1)该星球的质量为多大?
(2)若该宇航员在到达该星球表面前,曾释放了一颗小的观测卫星以观测该星球的情况。已知该卫星距星球表面高度为h ,则卫星的速度多大?环绕的周期又为多大?
| ||||||
| ||||||
| 得 分 | 评卷人 |
25、(20分)
质量分别为m1和m2的小车A和B放在水平面上,小车A的右端连着一根水平的轻弹簧,处于静止。小车B从右面以某一初速驶来,与轻弹簧相碰,之后,小车A获得的最大速度的大小为v . 如果不计摩擦,也不计相互作用过程中的机械能损失。求:
(1)小车B的初速度大小。
|
| 得 分 | 评卷人 |
26.(15分)
现有aA、bB、 cC、dD、eE五种短周期元素,它们都是生命中不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e; B、D、E都有多种同素异形体,B的化合物种类与A的化合物种类何者最多尚有争议。据此,回答下列有关问题:
(1) BA4的电子式是___________________,写出E的两种同素异形体的名称_________________________。CA3与EA3沸点关系是____________________________。
|
(3)X与A、B的某二元化合物在一定条件下反应得到一种常见的烈性炸药,其反应的化学方程式为______________________________________________________。
(4)由上述元素组成的某炸药其化学式用代号表示为B8C8D16。其分子中B元素原子间非极性键之间的夹角为90度,同种元素的原子在结构中是毫无区别的。该炸药的结构式是____________________-
| 得 分 | 评卷人 |
27.(16分)
已知一个碳原子上连有两个羟基时,易发生下列转化:
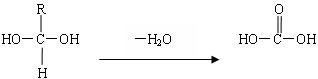 请根据下图回答:
请根据下图回答:
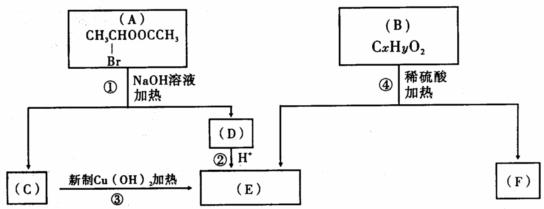
(1)E中的官能团的名称是_____________;反应③的类型是______________。C跟新制的氢氧化铜反应的化学方程式_________________________________________________
(2)已知B的相对分子质量为162,其燃烧产物中n(CO2)∶n(H2O)=2∶1,则B的分子式
为________________,F的分子式为___________________。
(3)F是制造电脑芯片中的高分子光阻剂的主要原料,F具有的特点是:①能跟FeC13溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为__________________________________________________________。
(4)化合物G是F的同分异构体,它属于芳香族化合物,能发生银镜反应。G可能有
|
| 得 分 | 评卷人 |
28.(17分)
某氯化铁样品中含有不少量FeCl2杂质,现要测定其中铁元素的质量分数,实验按以下步骤进行,请回答相关问题:
①衡量a g样品,置于烧杯中;
②加入适量盐酸和适量蒸馏水,使样品溶解,然后配成250ml的溶液;
③准确量取25.00ml操作②中配的溶液,置于烧杯中,加入适量的溴水,加热使反应完全;④趁热迅速加入过量氨水,充分搅拌,使沉淀完全;
⑤过滤,洗涤沉淀;
⑥将沉淀转移到蒸发皿内。加热、搅拌,直到固体全部由红褐色变为红棕色,冷却至室温,称量;⑦……
(1)溶解样品时要加入盐酸,原因是________________________________________________。
(2)加入溴水后,发生反应的离子方程式是_______________________________________
(3)加入氨水要过量的原因是_____________________________________________________
(4)洗涤的目的是洗去附着在沉淀上的_____________________________________________
(5)检验沉淀是否已经洗涤干净的方法是___________________________________________
(6)第⑥步的操作中,将沉淀物加热,冷却至室温,称量其质量为b1g,再次加热并冷却至室温,称量其质量为b2g,且b1-b2=0.3g,接下来的操作应当是_________________________
(7)第⑥步的操作中,使用到的玻璃仪器除玻璃棒外,还有___________________________________
(8)若蒸发皿的质量是w1,蒸发皿与加热后固体的总质量是w2,则样品中铁元素的质量分数是______________________________________________(列出算式,不需要化简)。
| 得 分 | 评卷人 |
29、(12分)
化合物CO、HCOOH和OHC-COOH(乙醛酸)分别燃烧时,消耗的氧气和生成的CO的体积比都是1:2。后两者的分子式可以分别看成是(CO)(H2O)和(CO)2 (H2O).也就是说,只要分子式符合[(CO)m (H 2O)n ](m和n均为正整数)的各种有机物,它们燃烧时消耗的O2和生成CO2的体积比总是1:2。
现有一些只含C、H、O三种元素的有机物,它们燃烧时消耗的O2和生成的CO2
|
(1)这些有机物中,分子量最小的化合物的分子式为____________
(2)某两种碳原子数相同的上述有机物,若它们的分子量分别为a和b(a<b ), 这b-a必定是_______________(填一个数字)的整数倍。
(3)在这些有机物中有一种化合物,它含有两个羧基,取0.2625克该化合物恰好能跟25.00 ml 0.100 mol/l的NaOH溶液完全中和, 由此可以计算得知该化合物的分子量是 _________________,并可推导出它的分子式是 ____________________。
| 得 分 | 评卷人 |
30、(18分)
某工厂生产了一种加酶洗衣粉,其包装袋上引有如下说明:
成分:含碱性蛋白酶等。
用法:洗涤前先将衣服浸于洗衣粉内数小时。使用温水效果最佳。
注意:切勿用于丝质及羊毛衣料。用后彻底清洗双手。
请回答下列问题:
(1)针对该洗衣粉设计了如下装置进行实验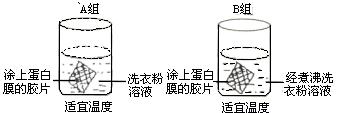
该实验的目的是_______________________________________________________________。
(2)一学生为探索该洗衣粉中酶催化作用的最适温度,参考上述(1)的实验材料及方法进行了如下实验,并把结果用图A、B表示。

① 由图可知,使用该加酶洗衣粉的最适温度约为_________。
②
|
③ 该同学在实验过程中可通过观察________________________________________现象判断酶的催化效率。
(3)该加酶洗衣粉的去污原理__________________________________________________ 。
(4)大力推广使用加酶洗衣粉代替含磷洗衣粉,有利于环境保护,这是因为______ _____
___________________________________________________________ _______ 。
| 得 分 | 评卷人 |
31、(24分)
Ⅰ(9分)本题所述的是四种常用育种方法的大致过程。回答下列问题:
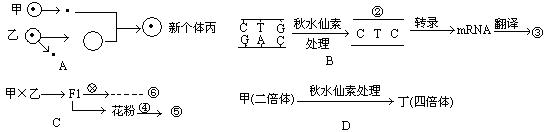
(1)A的育种过程在现代生物技术中称为________ ,利用这种方法育种产生了丙,丙的性状和甲极为相似。
(2)在B的育种方法中,倘若用②的碱基序列为模板转录形成mRNA,则该mRNA的碱基序列为_______________。
(3)C中获得⑥的育种方法叫_________ ;利用F1的花粉形成新个体⑤的方法叫做_________ ,该方法培育出的个体应称为_________ 。
(4)D是多倍体育种的方法,和B过程一样都用秋水仙素处理,但是原理和作用不同,秋水仙素在B是诱发产生_________ ,在D是诱发产生_________ ,前者一般作用于细胞周期的_________,后者作用于细胞周期的_________。
Ⅱ(15分)对水稻中的一个矮秆粳稻和一个高秆糯稻品种分别做以下检查:各取其花粉样品,滴一滴碘液,分别在显微镜下观察,发现矮秆粳稻的花粉全部被染成蓝黑色,高杆糯稻的花粉全部被染成红褐色,以这两个品种的水稻作为亲本进行杂交实验。结果如下:
①F1全部是粳稻。
|
③F1抽穗开花,取其花粉样品,滴碘液,在显微镜下观察,发现约![]() 花粉被染成蓝黑色,
花粉被染成蓝黑色,![]() 被染成红褐色。
被染成红褐色。
④F2中,约![]() 为粳稻,
为粳稻,![]() 为糯稻。
为糯稻。
⑤F2种下去,不管粳稻还是糯稻,长成的植株都约有![]() 为高秆,
为高秆,![]() 为矮秆。
为矮秆。
⑥检查部分F2矮秆植株的花粉,发现有些花粉被染成红褐色。
根据以上事实,回答下列问题:(不考虑基因突变)
(1)上述杂交实验中,亲本矮秆粳稻和高秆糯稻的基因型分别为_________、_________。(茎的高度由A—a控制,粳稻、糯稻由B—b控制)
(2)解释在F1中花粉被碘液染色后两种颜色比例呈1∶1的原因________
。
|