高考理科综合复习化学部分能力测试
供参考的相对原子质量:H-1 C-12 O-16 Na-23 Al-27 Cl-35.5
Ca-40 Fe-56 Cu-64 A g-108
6、我市是中国西部化工城,当前,贯彻党的十七大精神、推进“节能减排”工作,促使化工企业可持续发展具有极为重要的意义。下列叙述与“节能减排”不相符的是( )
A、我市盛产煤,在调整能源结构中,应加大燃煤在能源结构中的比率
B、化工生产中,严格治理三废(废水、废气、废渣),并尽可能把“三废”变废为宝
C、硫酸生产过程中,在沸腾炉旁设置“废热”锅炉,产生蒸气来发电
D、大力发展洁净煤技术,将煤液化、气化处理后,用于工业生产和日常生活
![]() 7、X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z,实验测知,Z晶体具有较高的熔点和沸点,则下列说法正确的是( )
7、X元素的1个原子失去2个电子转移到Y元素的2个原子中去,形成化合物Z,实验测知,Z晶体具有较高的熔点和沸点,则下列说法正确的是( )
A、固体Z与干冰属于同一晶体类型 B、化合物Z的电子式为:
C、化合物Z在熔融状态下可以导电 D、化合物Z的化学式为:YX2
8、社NA为阿伏加德罗常数,下列有关叙述正确的是( )
A、标准状况下,11.2L三氧化硫中含有的分子数为0.5NA
B、常温常压下,铁与稀盐酸反应放出2gH2时,转移的电子数为2 NA
C、7.8gNa2O2晶体中含有的阴离子数为0.5 NA
D、18g重水(D2O)中含有的电子数为10 NA
9、在以下给定的四种溶液中,加入后面的四种离子,各离子一定能在给定溶液中大量共存的是( )
A、c(H+)<c(OH-)的溶液中:S2- SO32- K+ Na+
B、含大量Fe3+的溶液中:NH4+ OH- SO42- Br-
C、与Al反应放出H2的溶液中:Mg2+ K+ HCO3- NO3-
D、pH=1的溶液中:Fe2+ NO3- I- Na+
10、已知:在10mL盐酸、氯化铝和氯化铁的混合溶液中,各阳离子的物质的量浓度相等,氯离子的物质的量浓度为7mol/L,向此溶液中加入1mol/L的NaOH溶液,至沉淀质量不再变化,此时所需NaOH溶液的体积为( )
A、70mL B、80mL C、50mL D、40mL
11、已知:99℃时,KW=1.0×10-12。在该温度下,测得0.1 mol/L的NaA溶液pH=6,则下列说法正确的是( )
A、HA在水溶液中的电离方程式为:HA![]() H++A-
H++A-
B、NaA溶液中存在离子浓度关系:c(Na+)+c(OH-)= c(H+)+c(A-)
C、0.01 mol/L的HA溶液pH<2
D、体积相等pH=1的盐酸、HA溶液分别与足量的Zn反应,HA溶液产生的H2多
![]() 12、在某容积为2L的密闭容器中,加入0.2molSO2和0.1mol
O2,在催化剂存在的情况下,高温反应,发生反应为:2SO2+O2
2SO3;△H=-196.6kJ/mol。下列说法正确的是( )
12、在某容积为2L的密闭容器中,加入0.2molSO2和0.1mol
O2,在催化剂存在的情况下,高温反应,发生反应为:2SO2+O2
2SO3;△H=-196.6kJ/mol。下列说法正确的是( )
A、能说明反应达到平衡的标志是:容器中SO2、O2、SO3的物质的量之比为2:1:2
B、反应达到平衡时,放出热量为19.66kJ
C、实际生产中,该反应选定400℃~500℃为操作温度,这可用勒夏特列原理解释
D、反应达到平衡时,SO2和O2的转化率相等
13、已知Cu2S与一定浓度的HNO3可发生以下反应:
3Cu2S+26HNO3=3CuSO4+3Cu(NO3)2+15NO2↑+5 NO↑+13H2O
下列说法正确的是( )
A、Cu2S既是还原剂,又是氧化剂
B、3mol Cu2S发生反应,有24mol电子转移
C、产物中只有CuSO4是氧化产物
![]() D、参加反应的HNO3中有 作氧化剂
D、参加反应的HNO3中有 作氧化剂
26、(16分)A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。
(1)写出A、D的元素符号:
A ,B 。
(2)由A、B、C三种元素形成的化合物的电子式为 ,这种化合物形成的晶体中所含的化学键类型有 。
(3)A2B的沸点高于A2D,其原因是 。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是 (用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分的挥发),溶液的pH近似为7,请写出该过程的总反应方程式 。
27、(14分)下图是中学化学常见物质的转化关系(某些反应条件及部分产物已略去),A、G为日常生活中的常见金属。B、C、E、I、J为气体,其中C为黄绿色气体,J为红棕色气体。D为黑色固体,M为红褐色胶体。
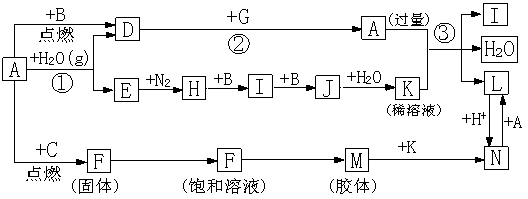
请回答下列问题:
(1)A元素在周期表中位于 周期 族。
(2)以F饱和溶液制备M胶体的操作为
。
(3)鉴别L溶液和N溶液的最简单的物理方法是 。
(4)反应③的离子方程式为 。
(5)已知:在通常状况下,反应②中,1molG物质发生反应,放出akJ热量,则该反应的热化学方程式为 。
28、(13分) 如图所示的实验装置,丙为一张用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹。丁为直流电源,x、y为电源的两极。G为电流计,A、B、C、D均为石墨电极。闭合K2、断开K1,一段时间后,A、B两个电极产生的气体体积之比为
2:1。请回答下列问题:

(1)M溶液可能是 (填以下选项的字母)
A、KNO3溶液 B、Ba(OH)2溶液 C、H2SO4溶液 D、NaCl溶液 E、CuSO4溶液
(2)x为 极(填“正”或“负”),C极的电极反应式为 。
(3)滤纸丙的m端发生的现象为 。
(4)若乙池中AgNO3溶液电解后体积为100mL,测得溶液的pH=1,则乙池中C极析出的固体质量为 g。
(5)再电解一段时间后,甲池中A、B极均有气体包围,此时闭合K1,断开K2,发现A、B极的管内气体体积减少,且电流计G指针发生偏转,则A极电极反应式为 。
29、(17分)实验室用下列仪器、装置和药品制取并净化CO2,然后用CO2与Na2O2反应制取O2。
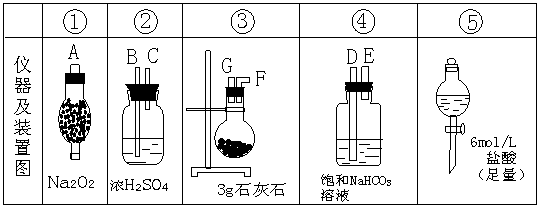
图中A、B、C、D、E、F、G表示玻璃管接口,接口的弯曲和伸长部分未画出。请根据要求填写下列空白。
(1)装置②的作用是 。
(2)若所制取的气体按从左向右流向时,上述各仪器、装置的组装顺序是(填各仪器、装置的序号) 接③接 接 接 。其中②与④装置相连时,玻璃管接口应是 接 。(填接口的字母)
(3)装置④中发生反应的离子方程式是 。
(4)请用集气瓶、量筒、导管、双孔塞,设计一个测定O2体积的装置,在方框中画出你设计的装置图。
| |
(5)已知:该石灰石的实际纯度(CaCO3的质量分数)为60%,且其中杂质不与盐酸反应。为使实验顺利进行,需Na2O2过量,则Na2O2质量不得少于 g;某同学在上述实验中测得产生的O2共224mL(标准状况下测定,不考虑损失),则该同学测出的石灰石的纯度(CaCO3的质量分数)为 ,石灰石的测定纯度与实际纯度之间产生误差的原因是 。
泸州市高中2008级第一次教学质量诊断考试
理科综合能力测试化学部分答案
一、选择题(每小题6分,共48分)
6、A 7、C 8、B 9、A 10、B 11、B 12、D 13、D
二、非选择题(共60分)
26、(16分)
(1)H(2分),S(2分);
(2)![]() (2分),离子键、共价键(2分);
(2分),离子键、共价键(2分);
(3)H2O分子之间存在氢键(2分);
(4)ClO-+H2O
![]() HClO+OH-(3分),2NaClO=2NaCl+O2↑(3分)
HClO+OH-(3分),2NaClO=2NaCl+O2↑(3分)
27、(14分)
(1)四(2分),Ⅷ(2分);
(2)取一个烧杯,加入20mL蒸馏水,加热至沸,然后向沸水中滴加FeCl3饱和溶液
1mL~2mL,继续煮沸,待溶液呈红褐色为止;(2分)
(3)观察溶液的颜色(2分);
(4)3Fe+2NO3-+8H+==3Fe2++2NO↑+4H2O(3分);
(5)3Fe3O4(s)+8Al(s)==4Al2O3(s)+9Fe(s);△H=-8akJ/mol(3分)。
28、(13分)
(1)A、B、C(3分);
(2)正(2分),Ag++e- ==Ag(2分);
(3)滤纸变蓝(2分);
(4)1.08(2分);
(5)H2-2e-==2H+(2分)。
29、(17分)
(1)干燥CO2气体(2分);
(2)⑤…④②①(2分),E、B(2分);
(3)H++HCO3-=H2O+CO2↑(3分)
(4)(2分)

(5)1.404(2分);66.77%(2分);在除HCl时,NaHCO3与HCl反应生成了少量的CO2,
使CO2的总体积增多,从而使石灰石的测定纯度偏大(2分)。