![]()
|
| 学科: 生物 年级:高三 |
| 版本:冲刺版 期数:2342
本周教学内容:专题十五 生物学跨学科综合例举 |
【经典例题解析】
例题1 能源是人类生存和发展的重要因素,请回答下列有关能源问题:
(1)人类所能使用的能量绝大多数来源于太阳能,捕获太阳能的生物主要为绿色植物。绿色植物能够通过光合作用把太阳能转化为化学能,写出光合作用的总反应式:
________________________________________________________________。
(2)根据《科学美国人》杂志,在1971年7月号刊登的《地球的能量资源》一文中提供的数据,到达地球表面的太阳能辐射通过光合作用途径提供的能量为40×109kJ·S-1。
试问:①通过光合作用,每年约有__________kJ的太阳能转变为化学能。
②每年由绿色植物通过光合作用为我们的生存环境除去CO2的质量为m,试根据能量关系列出m的计算式,列式中缺少的数据用符号表示。M=_________________。
(3)人类开发月球已为时不远,科学探测表明,月球土壤中富含氦-3,其资源总量初步估算达100万~500万吨,人类开发利用月壤中的氦-3的意义是什么?___________
(4)煤、石油、开然气、水能及生物能等是多年来大规模使用的能源,被称为______能源(用“常规能源”或“新能源”填充,下同),而核能、地热、海洋能、沼气以及太阳能、风能等被称为_________能源。
(5)水能是可再生能源,可持续地利用它来发电,为人类提供“清洁”的能源。若一水力发电站水库的平均流量为 Q(m3·S-1),落差为 h(m)发电效率为![]() ,则全年发电量 A(kw·h)为_______________
,则全年发电量 A(kw·h)为_______________
(6)已知(C6H10O5)n+nH2O→3nCO2+3nCH4+能量,请设想出这一反应的实际价值和意义。
________________________________________________________________________
解析 本题以人类生存与发展的重要支撑——能源为背景,考查了与生物有关的物理问题及化学问题。
(1)光能是取之不尽,用之不竭的能源,在地球上绿色植物的光合作用是能够将太阳能转变成化学能为人类及其他生物利用的惟一途径。根据生物学知识,即可写出光合作用的方程式:
6CO2+12H2O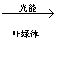 C6H12O6+6H2O+6O2
C6H12O6+6H2O+6O2
(2)①根据题意,到达地球表面的太阳辐射能中,能被地球上的绿色植物通过光合作用所固定的太阳能为40×109kJ·S-1,则一年由光合作用所固定的太阳能W为:
W=40×109kJ·S-1×365d×24h×60m×60S×=12.6×1018kJ
即有1.26×1018kJ的太阳能转化为化学能。
②利用一般的化学计算方法,设参与光合作用的CO2的质量为mkg,则
6CO2+12H2O→C6H1206+6H2O-QkJ
6×44×10-3kg QkJ
mkg 1.26×1018kJ
m=![]() =
=![]() kg
kg
其中Q为每生成1mol葡萄所需要吸收的太阳能的量。
(3)对地外世界的了解,对20世纪自然科学最新发展情况的了解,也是学生科学素质的组成部分。由物理知识可知:3He是核聚变的原料,是人类将来可供长期使用的清洁、安全、高效的核聚变发电燃料。但到目前为止,人类由于技术原因,还不能实现冷核聚变发电,但可以预测在不远的将来一定能够实现核聚变能的和平利用。
(4)根据一般性的地理知识,按能源利用技术状况分:常规能源——多年大规模使用;新能源——近若干年才开始利用,现在又有新的利用方式的能源。按题意,煤、石油、天然气、水能及生物能等是多年来大规模使用的能源,应属于常规能源;而核能、地热、海洋能、沼气以及太阳能等应属于新能源。
(5)由物理知识可知:水的密度为![]() =1×105kg·m-3,在1S内流水重力势能减少了△Ep=pQgh,转化为电能为:
=1×105kg·m-3,在1S内流水重力势能减少了△Ep=pQgh,转化为电能为:
△Ep·![]() =
=![]() pQgh,即设水电站发电功率为:P=
pQgh,即设水电站发电功率为:P=![]() pQg(瓦)
pQg(瓦)
由W=Pt得:全年发电总量为:
A=W=![]() pQght=
pQght=![]() =8760
=8760![]() pQgh(kw·h)
pQgh(kw·h)
(6)按题意,是人类应如何合理开发利用生物能,因为地球上的绿色植物一年通过光合作用所固定的太阳能的总量是非常巨大的,这些能量都贮存在糖类等有机物。在秸秆、杂草等农作物的废弃物中蕴藏着大量的生物能,充分利用这些生物都是解决农村能源短缺的问题。目前常用的主法是将秸杆、杂草等农作物的废弃物在发酵池中发酵产生沼气,为农村提供能源。
答案 (1)6CO2+12H2O C6H12O6+6H2O+6O2 (2)12.6×1018kJ
3.33×1017/Q(kg)(式中Q表示每生成1mol葡萄糖所需要吸收的能量 (3)3He将是人类可长期使用的清洁、安全、高效的核聚变发电燃料
(4)常规新 (5)A=876
C6H12O6+6H2O+6O2 (2)12.6×1018kJ
3.33×1017/Q(kg)(式中Q表示每生成1mol葡萄糖所需要吸收的能量 (3)3He将是人类可长期使用的清洁、安全、高效的核聚变发电燃料
(4)常规新 (5)A=876![]() Qgh(kw·h) (7)利用秸杆、杂草、树叶等农作物的废弃物经微生物发酵之后便有沼气产生,它是农村能源的重要来源。也是扩大肥源,提高肥效和改善农村卫生条件的重要措施
Qgh(kw·h) (7)利用秸杆、杂草、树叶等农作物的废弃物经微生物发酵之后便有沼气产生,它是农村能源的重要来源。也是扩大肥源,提高肥效和改善农村卫生条件的重要措施
例题2 随着工业化程度的提高以及世界范围内的人工采伐,使森林面积锐减,导致大气中CO2浓度迅速增加;同时生物的新陈代谢也产生CO2。大气中CO2对来自太阳的短波辐射几乎不吸收,但对从地表射向太空的长波光,特别是红外辐射有强烈的吸收作用,从而阻碍了地球向太空辐射能量。
(1)人们习惯上把大气中以CO2为主的气体所产生的效应称为( )
A.光热效应 B.光气效应 C.温室效应 D.光电效应
这种效应会使_________________。
(2)大量采伐森林会使大气中CO2浓度增加的原因是_________。写出植物的这种作用的总反应方程式:___________________。
(3)为了减缓大气中CO2浓度的增加,除了植树造林外,主要可行的措施还有_____等。
A.优化能源结构
B.减少地球上的生物,因为它们的新陈代谢要产生大量CO2
C.利用化学方法回收空气中的CO2
D.对燃料及燃烧进行优化处理
E.将燃油汽车改为燃液化气汽车
F.降低工业化程度
(4)植树造林不仅可以减少空气中的CO2,还可中以防止水土流失,防风固沙减少灾害等。风沙的移动会带来很多灾难,而它又与风速有关。森林对风有很好的减速作用。若两地间风速差的平方与两地距离的2/3次方成正比,比例系数为k,若风吹到林区时速度为 30m/s,要求减弱5m/s,则林区的宽度为多少米?此时风的能量减少为原来的多少倍?(设空气密度恒定)
解析 本题以近年来大家比较多地关注的环境问题和大气中以CO2为主的气体所产生的“温室效应”为出发点,结合平时所学的一些理论知识并以此来考查同学对所学知识的了解程度和综合运用能力,以及分析问题、解决问题的能力。
(1)二氧化碳的这种使短波进入而阻止长波逸出的单向阀门作用,类似温室玻璃的作用,所以习惯上称“温室效应”。地球吸收了太阳的辐射热,又被CO2吸收而不能射向太空,减缓了热量散失,这种作用如同将地球置入一大温室中,所以会使全球气温上升而使“全球变暖”。
(2)森林以绿色植物为主。绿色植物光合作用吸收大量的CO2,使大气中CO2量减少,而大量采伐使这种作用减弱,CO2的减少减缓,而CO2的产生仍持续,所以采伐森林会使CO2浓度增加。
(3)需要对能源及能源结构和燃料的成分及燃烧的产物有所了解。另外对方法的可行性还要加以考虑,如B、C两选项在本题中其燃烧产物仍为CO2气体,不能减缓CO2浓度增加,只是其环保效果好不产生SO2等气体。
(4)第一问是纯数学计算。由题意设林区宽为S,则(30-5)2=KS![]() ,解得:S=15625k
,解得:S=15625k![]() 。第二问,设单位时间吹到同一面上风的质量为m,则m数值上等于pS·v,而Ek=
。第二问,设单位时间吹到同一面上风的质量为m,则m数值上等于pS·v,而Ek=![]() mv2=
mv2=![]() pSv3。所以其能量之比正比于速度的三次方,即能量减少为原来的(
pSv3。所以其能量之比正比于速度的三次方,即能量减少为原来的(![]() )3=
)3=![]() 倍。
倍。
答案 (1)C,全球变暧(或意思对即可)
(2)植物光合作用吸收的CO2量减少了
6CO2+12H2O C6H12O6+6H2O+6O2
C6H12O6+6H2O+6O2
(3)AD (4)15625k![]() (米),l/216 倍。
(米),l/216 倍。
例题3 请合理规划一个乡镇的一些基本设施。下表所列各项设施在此乡镇内应怎样选址,试根据要求在图15-1的设点处(圆圈)填上表中编号(见图15-1)。
| 项目 | 编号 | 规划要求 |
| 学校 | 1 | 宁静,上学方便 |
| 商场 | 2 | 居民购物便利 |
| 疗养所 | 3 | 光照充足,空气清新,地势高,干燥,很少噪声 |
| 电视发射台 | 4 | 便利发射 |
| 火力发电厂 | 5 | 减少对居民区的大气污染,燃料运输方便 |
| 自来水厂 | 6 | 能获得洁净的水源 |
| 垃圾处理场 | 7 | 远离居民区,防止污染水体 |
| 造纸厂 | 8 | 取水便利,防止污染水体 |
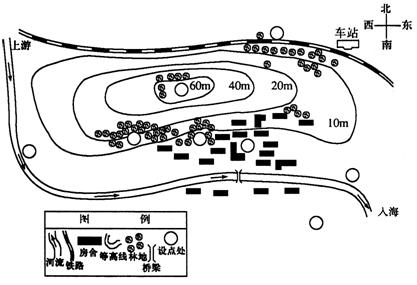
图15-1
解析 此题主要是多方面能力的综合,包括辨识地图所示方位、图例等高线等,要求根据各项目的物理、化学、生物、社会、政治、居民的日常生活等属性,考虑到社会、政治、经济和环境的综合效应,进行科学选址。
答案 见图15-2
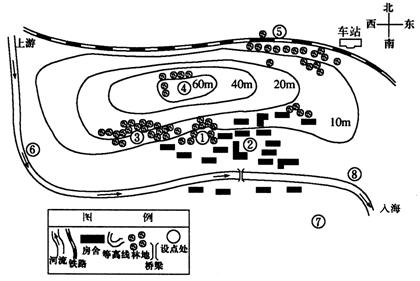
图15-2
例题4 图15-3为我国长江中下游地区某地的生态结构图,根据所提供的信息,完成下列有关问题:
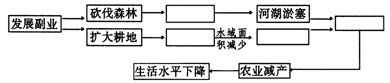
图15-3
(1)将正确的选项填在上表相应的空白格内
A.流域蓄水能力降低 B.围湖造田 C.水土流失 D.旱涝增多
(2)为了保障本地区农业的良性持续发展,目前应当采取的主要措施是( )
A.计划生育、控制人口 B.绿化造林、兴修水利
C.退耕还湖、扩大水域面积 D.发展乡镇企业,增加人均收入
(3)围湖造田对本地区水患的影响在于:
A.___________________________________________________________
B.___________________________________________________________
(4)该地区旱涝发生的规律是:
A.___________________________________________________________
B.___________________________________________________________
(5)综合上述材料反映了哪些辩证唯物主义原理?
(6)1998年夏季,长江中下游地区发生了有史以来最大的洪涝灾害,是天灾还是人祸?你是怎样理解的?
解析 本题以长江中下游地区近年来不断发生洪涝灾害为背景,以生态环境遭到人为的破坏,人们得到大自然严酷惩罚的事实为依据进行题目立意,意义深远,本题涉及地理、生物、自然、政治、经济等等方面的知识,有理论深度和综合的强度。有针对性和前瞻性,对培养学生遵循科学规律办事和科学的决策能力大有益处。
答案 (1)见图15-4
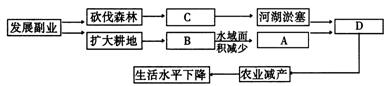
图15-4
(2)C (3)A、减小了湖区的水域面积,降低了流域的蓄流能力;B、降低了湖泊对洪水的调节能力,增加了干流的排洪负荷 (4)A、梅雨过强,梅雨期过长则涝害发生;B、梅雨期过短,梅雨过弱则旱灾发生 (5)①事物的运动是有规律的,规律是可以认识和掌握的,发挥人的主观能动作用必须以尊重客观规律为基础;②世界上一切事物都处在普遍的联系之中,没有任何一个事物孤立地存在的,整个世界是一个普遍联系的整体。③世界上的一切事物都是变化发展的,一切事物的变化发展都是从量变引起质变的;④实践是认识的来源,发展的动力,认识的根本目的就是把理性认识应用于实践,去指导实践,实践是检验认识是否正确的惟一标准 (6)既是天灾,更是人祸。说是“人祸”:长期以来由于对生态环境保护不力,森林资源被乱砍乱伐,造成长江中上游水土流失严重,中下游湖泊泥沙淤积,再加上长江中下游图湖造田,湖泊面积萎缩,蓄水调节功能减弱;说是“天灾”:恰逢长江中下游地区梅雨季节,我国受厄尔尼诺现象影响,降水量猛增,降雨集中,持续时间长。
例题5 1999年上半年,比利时爆发的“二口恶 英”食品污染事件使得世界各国民众都对食品中是否含有“二口恶 英”大起警惕之心。“二口恶 英”是一种含C、H、O、Cl等元素的混合物,对人体有很强的致畸作用,其主要成分中,毒性较大的名称为:2,3,6,7-四氯代二苯并二口恶 英,结构简式如图15-5所示。
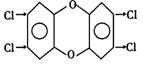
图15-5
(1)写出以上物质的化学式:___________________________
(2)结构中的![]() 部分称为二口恶 烷,在有机化学上是典型的___________结构。
部分称为二口恶 烷,在有机化学上是典型的___________结构。
(3)自然环境中的“二口恶 英”一般是怎样产生的?
(4)“二口恶 英”的化学稳定性强,是脂溶性物质,一旦进入环境或人体,由于它能在脂肪中高度溶解,从而能在生物体内积畜而很难排出,因其能在环境中持续存在称为持续性有机污染物,“二口恶 英”为什么有亲脂性?
(5)“二口恶 英”不仅可以通过食物毒害人类,还可以通过存在于空气中的气态物质伤害人类,据调查,在高浓度“二口恶 英”环境下的工人,患癌症的死亡率比普通人群高60个百分点,空气中“二口恶 英”是通过哪些途径进入人体组织细胞内的?
(6)在食物链中,生物所处的营养级越________,体内的“二口恶 英”含量就越多,这种现象称为什么?
(7)“二口恶 英”对人体会产生怎样的危害?
(8)“二口恶 英”的形成需要3个条件:有机物、氯和反应环境,这符合化学上的什么原理?
解析 比利时的“二口恶 英污染鸡”事件继疯牛病危机之后欧洲最大的一起食品污染案,波及世界各地。本题能过“二口恶 英”的剖析,让学生能用学过的知识进行知识迁移,触类旁通,举一而反三,进行发散性思维。
(1)要求学生根据“二口恶 英”的结构式写出分子式,“二口恶 英”的分子式为:C12H4O2Cl4。
(2)“二口恶 英”结构式中的![]() 结构,在有机化学上是一种典型的醚结构。
结构,在有机化学上是一种典型的醚结构。
(3)“二口恶 英”是工业化社会产生的恶果之一。自然环境中的“二口恶 英”一般是在焚烧有毒的生活垃圾(特别是合有大量废旧塑料制品的垃圾)时产生的。在自然界中,分解者在分解生物有机物的过程中是不会产生的。
(4)“二口恶 英”是有机物,分子结构中无亲水基因,也不带有极性,所以它不溶解于水,而溶解于有机溶剂中,而且它在脂类中的溶解度很大。
(5)食物中的“二口恶 英”进入人体的途径,主要是通过消化道的上皮细胞吸收的,小肠绒毛上皮细胞吸收它的方式是扩散,随脂肪等物质一起进入小肠绒毛的毛细胞淋巴管,随淋巴循环进入血液,再运输到全身各处,在脂肪组织中贮存起来。“二口恶 英”在进入人体的过程中,没有经过肝脏的解毒作用,所以在体内几乎不被分解,进入脂肪组织后也几乎不被排出体外。空气中的“二口恶 英”还可以通过呼吸道、粘膜、皮肤进入人体组织细胞。
(6)“二口恶 英”通过食物链进入各种生物体内,并积累在其脂肪层或脏器中。一般来说,动物寿命越长,吃的食物越多,或者是营养级别越高,体内积累的“二口恶 英”就越多。这种有毒物质通过食物链而在生物体内逐步浓缩的现象称为“生物富集作用”。
(7)当人食用了被“二口恶 英”污染的禽畜的肉、蛋、奶及其制成品,“二口恶 英”也就进入了人体,在人体中积累起来,而且几乎不可能通过消化系统或泌尿系统排出去。当人体内的“二口恶 英”堆积达到一定数量时,就会导致人体组织发生癌变。
(8)“二口恶 英”中含有C、H、O、Cl元素,根据质量守恒原理,其可以由含这些元素的物质反应生成。
答案 见解析。
例题6 随着社会经济的发展,迫切需要大量的能源。核能应用作为第三次技术革命的标志之一,受到人们普遍的重视。
(1)早在20世纪40年代就发生了与核能有关的重大历史事件,试举一例。
(2)二次世界大战后,开始了和平利用核能的时代。到80年代,我国已有两座正式并网试用的核电站。它们分别是______省境内的_________和________省境内的_______。其中__________是我国自行设计制造的。我国正在建设中的第三座核电站在_________省境内,位于____________铁路线的东端。
(3)试从影响工业布局因素的角度,简述在上述三地建造核电站的理由。
(4)按产业分类,核电业属于________产业。我国开发这一新能源,体现了邓小平关于__________的重要观点。
(5)核电站中要用核反应堆使重核裂变,将释放出的巨大能量转换成电能。
①完成下列核反应方程式:
![]() +
+![]() →
→![]() +
+![]() +3
+3![]() +8+
+8+![]() +反中微子
+反中微子
(反中微子的质量数和电行数均为0)
②写出核裂变反应和一般化学反应的不同点。(请答3点)
③核电站在热量传递的循环系统中应用了钠钾合金作为传热介质,试根据钠钾合金的性质说明这一应用的两点理由。
(6)依据上述核反应方程式,计算:
①1kg铀235全部裂变产生多少kJ的能量?
②需要燃烧多少吨标准煤才能释放出相同的能量?
已知:铀(U)核的质量为235.0439u中子(u)质量为1.0087u,钕(Nd)核的质量为142.9098u,锆(Zr)核的质量为89.9047u,1u=1.6606×10-27kg,燃烧出标准煤能产生2.93 ×104kJ的热量。
(7)核反应除释放巨大的能量外,还可以用来生产各种放射性同位素。请分别阐明放射性同位素的辐射育种和临床治癌原理。
解析 这是一个围绕核能设计的跨学科综合题。
(1)核能又称原子能,原子核发生裂变或聚变反应时释放出来的能量称为原子能。这种能量比燃烧同量物质放出的能量约大数百万倍。利用原子核反应所放出的能量起杀伤破坏作用的武器叫核武器。二战期间,德、美等大国竞相研制这种新型的武器,最后由美国率先研制成功。1945年,二战结束前夕,美国首次将这种武器用于实战中,在日本的广岛、长崎投掷原子弹,造成巨大的伤亡。1949年,苏联打破了美国的核垄断,研制成原子弹。本题考查学生再认识再现历史知识的能力。
(2)广东的大亚湾核电站是引进法国的资金和技术兴建的;浙江的秦山核电站是利用我国的资金和技术自行设计建造的;第三座正在建设中的核电站在江苏的连云港,是引进苏联的技术和部分资金建造的。连云港地处欧亚大陆桥铁路线的东端(即陇海铁路线的东端)。
(3)解本题的切入点是分析两个核电站所在区域的区域特征,提取它与布局因素的关系,筛选作答。主要应从建立核电站的原因,即从能源的供求量和核能的特点来分析,由于核电的开发投资大,技术要求高,所以,一般核电站往往要建在邻近经济发达、技术雄厚、资源需求量大而常规能源缺乏的地区,例如我国就选择了珠江三角洲和长江三角洲这两个地区。
(4)从核电业这一新能源,考查三大产业的知识和邓小平理论。从产业结构的知识可以知道:核电工业应该属于第二产业,我国开发这一新能源体现了邓小平理论中科学技术是第一生产力的重要观点。
(5)核电利用的是重核裂变时所释放的巨大能量。用中于轰击铀的原子核,使铀原子核分裂成两个(或更多个)中等质量的原子核并放出2~3个中子,这样的过程称为重核裂变。
①发生核反应时,核电荷数和质量数都是守恒的,也就是说核反应方程左、右两边的核电荷数和质量总数是分别相等的,核反应方程的平衡依据的就是这个原则。
从方程的左边,我们可以算出铀235和中子的质量数之和为236,核电荷数之和为92。而方程的右边Zr的核电荷数及质量数均未知,Nd核电荷数为60、质量数为143,中子质量数为1、电行数为0,电子质量数为0,电荷数为-1,反中激子质量数、电荷数均为0。
运用核质量数守恒原理,设Zr质量数为x,则235+=143+x+3·1+8·0,得x=90。
运用核电荷数守恒原理,设Zr电荷数为y,则92+0= 60+y+3·0+8·(-1),得y=40。
所以填空题![]() .
.
②核反应和化学反应的本质是不同的,对单位质量的物质,核裂变反应所释放出来的能量远远大于化学反应所释放的能量。在核反应中,原子核发生了变化,一种元素变成另外一种或几种元素,在化学反应中,原子核不发生变化,元素在反应前后不变,所以说核反应是原子层次上的变化,而化学反应是分子层次上的变化。一种同位素不论处于何种价态,它们核反应性质是相同的,而它们的化学性质是不同的,同一元素的不同同位素的化学性质完全相同,但它们的核反应性质是不同的。因为它们核内的中子数不同。
③小题则着重考查学生对常见金属的物理性质及其用途的了解。钠和钾的熔点低,钠和钾的合金的熔点更低,在室温下为液态,可在管道中自由流动,而钠和钾又都是热和电的良导体,所以钠钾合金可作为电站的热量传递循环系统中的传热剂。
(6)从能量的角度去认识核电,可通过物理的计算进行。
铀核裂变发生质量亏损,减少的质量等于反应前中子和铀核的质量与反应产物的总质差(不是质量数之差,因为质量数之差为0,质量亏损小于1个质量数单位),发生质量亏损时放出能量△E=△m·c2,式中△m为减少的质量,c为光速。
核的质量单位用u来表示,1u=1.6606×10-27kg
铀裂变反应中释放的能量计算如下:
裂变以前的数量之和: 裂变以后的数量之和:
![]() 235.0493u
235.0493u ![]() 142.9098u
142.9098u
![]() 1.0087
1.0087 ![]() 89.9047u
89.9047u
____________________
236.0526u
![]() 3.0261u
3.0261u
_______________________
235.8406u
反应过程中质量减少△m=0.212u
反应中释放的能量:△E=△m·C2=0.212×1.6606×10-27×(3×108)2J=3.168×10-11J
所以,1kg铀全部裂变时共释放的核能等于1kg铀的原子总数乘以每个铀核裂变放出的能量。
△E=![]() ·NA·△E=
·NA·△E=![]() =8.12×1010kJ
=8.12×1010kJ
将面△E的值除以燃烧1kg标准煤放出的热量,即可算出1kg铀完全裂变放出的能量相当于燃烧多少kg标准保放出的能重,即:![]() =2.77×106kg=2.77×103t
=2.77×106kg=2.77×103t
(7)在农科研和生产实践中常用诱变育种的方法来选育良种,其原理是利用各种物理、化学等方法去处理生物,如利用放射性同位素的辐射来育种,通过放射性同位素的射线对遗传物质的影响,以此来诱发生物发生基因突变,这种方法可以极大地提高基因突变的频率。基因突变后通常可以产生新基因,决定出新的性状,然后再经过人们的选育,获得性状的大幅度改良的新品种。
由于放射性物质(如放射性同位素)处理生物可引起生物体基因突变等一系列反应,这些反应还包括可以杀伤细胞和抵制细胞分裂。所以这项技术也可用于临床治疗癌症,其目的是利用杀死癌细胞或抑制癌细胞的细胞分裂,这在临床上取得一定成效,但也有一定副作用。
答案 (1)美国在日本的广岛和长崎投掷的原子弹 (2)广东大亚湾核电站 浙江秦山核电站 秦山核电站 江苏欧亚大陆桥(或珑海) (3)珠江三角洲和长江三角洲地区,经济发达,技术雄厚,资源需求量大而常规能源缺乏
(4)第二,科学技术是第一生产力
(5)![]() ;②对单位质量的物质而言,核裂变产生的能量远远大于化学反应的能量。核反应是原子层次上的变化,而化学反应是分子层次的上变化(或核反应前后元素发生变化,化学反应前后元素不变);一种同同位素不论处于何种价态,它们的核反应性质是相同的,而它们的化学性质是不同的;同一元素的不同同位素它们的化学性质是相同的,但它们的核反应性质是不同的;③钠钾合金熔点低,常温下为液态,可在管道中自由流动 (6)1kg 铀共释放核能
;②对单位质量的物质而言,核裂变产生的能量远远大于化学反应的能量。核反应是原子层次上的变化,而化学反应是分子层次的上变化(或核反应前后元素发生变化,化学反应前后元素不变);一种同同位素不论处于何种价态,它们的核反应性质是相同的,而它们的化学性质是不同的;同一元素的不同同位素它们的化学性质是相同的,但它们的核反应性质是不同的;③钠钾合金熔点低,常温下为液态,可在管道中自由流动 (6)1kg 铀共释放核能
E=[![]() ×6.02×1023×(235.0439-142.9098-89.9047-2×1.0087)×1.6066×10-27×(3×108)2]J=8.12×1010kJ或
×6.02×1023×(235.0439-142.9098-89.9047-2×1.0087)×1.6066×10-27×(3×108)2]J=8.12×1010kJ或
E=[![]() ×NA×(235.0439-142.9098-89.9047-2×1.0087)×(1×NA)×10-3×(3×108)2]J=8.12×1013J=8.12×1010kJ需要燃烧2.77×103吨标准煤
×NA×(235.0439-142.9098-89.9047-2×1.0087)×(1×NA)×10-3×(3×108)2]J=8.12×1013J=8.12×1010kJ需要燃烧2.77×103吨标准煤
(7)辐射育种的原理:利用放射性同位素的射线对遗传物质产生影响,提高基因突变频率,从而选育出优良品种。临床治癌的原理:杀伤癌细胞或阻止癌细胞分裂
例题7 人类在数千年里已经喝过许多含酒精的饮料。酒精给人们许多快乐,也会引起许多悲伤、生病甚至死亡。请回答以下与酒精有关的问题:
(1)酒精的化学名称为乙醇,乙醇是醇类家族中的一员。所有醇类分子结构中都有的原子团是什么?写出乙醇的分子结构式。
(2)工业酒精能否饮用,为什么?
(3)已经喝过酒的驾驶员更有可能发生交通事故,这是因为他们的反应迟钝,他们通过眼睛接受外界信息作出反应的时间长了,说明为什么?
(4)酒精进入消化道在何处被吸收?
(5)说明为什么过量饮酒,肝脏特别易受损伤?
(6)饮酒会产生其他什么危害吗?
解析 本题涉及到关于酒精的一些化学知识和生物知识,有助于学生认识酒精对于人体的影响和酗酒对人体的危害。
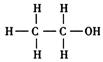
(1)醇类分子结构中有—OH原子团。乙醇的分子结构式为:
(2)工业酒精不能饮用。因为工业酒精含有有毒物质,这种物质大部分是甲醇。酒精中含有甲醇称为甲醇化酒精,喝了这种酒精会得重病。
(3)酒精对神经系统的作用机理是非常复杂的,目前还没有弄清。但已经确认的是,酒精对抵制神经细胞活动有特殊作用,酒精分子以某种方式阻止信使分子有效地传递信息,减缓信息通过突触(神经元的连结点)。酒精能减缓信息围绕身体和大脑的传递,抑制大脑和神经系统,所以酒精被称为镇静剂。量少时,酒精能帮助人们减缓紧张和焦虑,也使人更爱交际。但是,由于神经传递信息很慢,开车和操作机器容易出危险;体内酒精量增大时,酒精引起的冲动兴奋得不可抑制,将导致不受约束的行为和反常的肌肉刺激作用,因此能观察到酒精使人们失去控制,如语言变得含糊不清,失去平衡知觉等现象。非常大量的酒精会引起昏迷甚至死亡。
(4)酒精分子很小,通过自由扩散能很快被胃和小肠吸收,进入血液,一旦进入血液中,酒精很快被传到身体的所有部位。
(5)乙醇在肝脏中进行新陈代谢、通过氧化酶的作用,先氧化成乙醛,乙醛氧化成醋酸,醋酸再被氧化成二氧化碳和水,乙醇在肝脏中被氧化成二氧化碳和水时,释放出能量,这很像精在呼吸中氧化一样。如果能量没有在运动中消耗掉,能量将变成脂肪贮存起来。肝脏每小时只能忍受10mL的酒精,如果血液中经常有大量的酒精存在,肝脏就开始受损害,引起肝硬化。
(6)人们经常饮酒,第二天醒来虽然头痛和生病的感觉会消失,但会损害人的身体。除去损坏肝脏,酒精也能引起脑损伤、胃损伤和神经系统的问题。过度饮酒,也会引起性功能障碍、衰弱和其他心理问题。一些人喝酒不能控制自己,他们喝酒成痛,被称为酗酒者。
答案 见解析。
例题8 阅读以下材料,然后回答问题:
微生物对人类有着各种各样的用途,现在生物工程学家已能利用生物从矿石中提取金属。钢是一种很有实用价值的金属,可以从铜矿中提取。这些矿石中的铜往往与其他元素结合在一起,特别是硫。铜矿中还混有大量无用的岩石。有时,铜矿中的铜含量太低,以致于冶炼过程十分困难而且成本很高。在此,细菌能帮助我们。某些细菌能利用空气中的氧来氧化硫化铜矿石,把不溶性的硫化铜转化成为可溶的硫酸铜。这些细菌能忍耐铜化合物,这些铜化合物对于大多数生物来说是有毒的。因此,有时它们被称为“吃岩石的细菌”。
利用细菌提取铜的生产过程如图15-6。
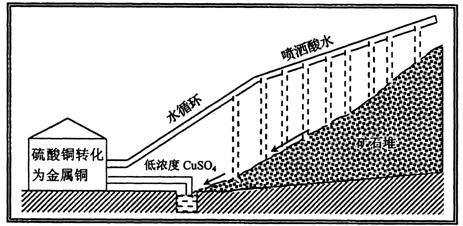
图15-6
在碎岩石和矿堆里,已经有细菌存在,所必需的是喷洒酸水以促进细菌的生长。在它们的生长过程中,硫化铜矿石被氧化成为硫酸铜,低浓度的硫酸铜溶液流到矿石堆的底部。然后,再从这种溶液中提取金属铜。水则可以循环使用,再回到矿石堆中。
在美国,百分之十的铜是用这种方法生产的。将来生物工程学家能用遗传工程技术来提高细菌的工作效率。
请根据上述材料,回答下列问题:
(1)这种“吃岩石的细菌”的新陈代谢类型是什么?
(2)写出细菌氧化硫化铜的化学反应式。
(3)除能忍耐铜化合物外,这种细菌还能忍受其他什么恶劣的生活条件?
(4)如果矿堆中的矿石被碎成小块,反应速度是否会有变化?为什么?
(5)从硫酸铜溶液中提取铜,简便而经济的方法是什么?写出反应式。
(6)普通生产铜的方法是在空气中燃烧硫化铜,这将产生哪些产物?比较生物工程法和普通方法,哪种方法生产铜更好?
解析 利用细菌提取金属是生物工程学上的一个实例。通过对此例的分析,可以培养学生阅读、理解和综合运用知识的能力,提高对生物科学方法的了解,认识到生物科学在满足人类的需求方面所具有的广阔前景。
(1)矿堆浸铜法实际上已为人们沿用了几百年,但只是在最近人们才认识到微生物在这个过程中的基本作用。参与反应的细菌是常见的硫杆菌(进行硫代谢)的细菌。这些细菌新陈代谢类型为自养需氧型。它们不进行光合作用,而进行化能合成作用,即能利用无机物氧化时产生的能量来合成自身需要的有机物。
(2)细菌氧化硫化铜的方程式为:CuS(固态)+2O2![]() CuSO4。在大多数情况下,硫化铜矿石的分子式比CuS复杂得多(其反应过程也十分复杂并包括许多步骤。但它们的基本结果是相同的,即把不溶性的铜矿化为可溶性的硫酸铜)。
CuSO4。在大多数情况下,硫化铜矿石的分子式比CuS复杂得多(其反应过程也十分复杂并包括许多步骤。但它们的基本结果是相同的,即把不溶性的铜矿化为可溶性的硫酸铜)。
(3)这种细菌喜欢恶劣的生活条件,如酸水、高温等。巨大的矿石堆像座小山,其中有数十亿吨岩石。氧化反应放出了大量的热。矿石堆的中心温度会很高,但在这种温度下细菌的生活反而更加活跃。
(4)如果矿石被碎成小块,反应会进行得更快,因为碎石块与氧气的接触面积增大,促进了氧化反应的进行。
(5)从硫酸铜溶液中提取铜,通常的做法是:把废铁加进溶液中,化学性质较活跃的铁就把铜转换出来。
CuSO4(液态)+Fe(固态)→FeSO4(液态)+Cu(固态)
(6)普通生产铜的方法是在空气中燃烧硫化钢,这将产生铜和SO2,一部分SO2必然会进入空气中,并进一步导致酸雨等。这种“微生物采矿法”同普通的冶炼法相比,具有以下几个优点:①即使含量较少的矿也可以被利用,这种方法适宜于被废弃的损坏矿堆;②与冶炼法不同,没有SO2排放到大气中,减少对环境的污染,实际上,硫细菌为我们提供了一条在燃烧前就把硫从矿中移去的途径;③能量成本远远低于冶炼法。
答案 (1)自养需氧型;(2)CuS(固态)+2O2![]() CuSO4;(3)较低的pH值和较高的温度;(4)增加了表面积,增加了与氧气的接触面积,有利于氧化反应的进行;(5)把废铁加进溶液中,化学性质较活泼的铁将铜置换出来,方程式为:
CuSO4;(3)较低的pH值和较高的温度;(4)增加了表面积,增加了与氧气的接触面积,有利于氧化反应的进行;(5)把废铁加进溶液中,化学性质较活泼的铁将铜置换出来,方程式为:
CuSO4(液态)+Fe(固态)→FeSO4(液态)+Cu(固态) (6)见解析。
例题9 如图15-7所示,将正在萌发的小麦种子放在一个广口瓶内,瓶内放一盛有 NaOH溶液的小烧杯,广口瓶与一水银流体压力计相连,假设萌发的种子用完了瓶中的所有气体,水银柱会升高到76cm处(等于大气压)。
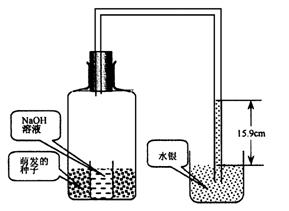
图15-7
(1)实验过程中,水银只升高15.9cm就不再升高了,这证明瓶中的空气被用了约___%(体积比),这证明种子只利用了瓶内的___________。
(2)此实验中放入NaOH溶液的作用是__________,反应方程式为_________。
(3)此实验证明了__________。相关的反应式为_________________。
(4)若实验中瓶内只放萌发的种子,则水银柱的变化为___________,理由是_________。
(5)水银柱升高15.9cm后,萌发的种子将进行________________。最终种子将死亡的原因是____________________________________。
(6)如果将小麦种子换成油菜种子(假定油莱种子进行呼吸时的底物是CH3(CH2)16COOH),实验中只放油菜种子而不使用NaOH,则液面将上升_______cm。(不考虑容器内压力的变化)
解析 一个大气压等于76cmHg,在大气中氧气占21%,其压强相当于76cmHg×21%=15.9cmHg,在本实验中萌发的种子进行呼吸作用消耗氧气释放二氧化碳,释放的二氧化碳被本实验装置中的氢氧化钠吸收,故水银柱将会上升。由于小麦种子中的主要成分是淀粉,在以糖类物质作为呼吸底物时,吸收的氧气和放出的二氧化碳的量是不等的,如呼吸底物以硬脂酸(CH3(CH2)16COOH)为例:CH3(CH2)16COOH+26O2→18CO2+18H2O+能量,从配平的反应方程式可以看出吸收的氧气比释放出的二氧化碳多。所以第(6)小题水银柱液面的升高为(1-18/26)×15.9=4.98(cm)
答案 (1)约21,O2;(2)吸收CO2,2NaOH+ CO2→Na2CO3+H2O;(3)萌发的小麦种子进行的主要是有氧呼吸;C6H12O6+6O2+6H2O![]() 6CO2+12H2O+能量 (4)即不上升也不下降,有氧呼吸以糖类为底物进行呼吸时吸收的氧气和释放的CO2等相等,总体积不变;(5)无氧呼吸,无氧呼吸产生的酒精对细胞有毒害作用;(6)4.89。
6CO2+12H2O+能量 (4)即不上升也不下降,有氧呼吸以糖类为底物进行呼吸时吸收的氧气和释放的CO2等相等,总体积不变;(5)无氧呼吸,无氧呼吸产生的酒精对细胞有毒害作用;(6)4.89。
例题10 图15-8表示从南极(90°)经地赤道(0°)到北极(90°),同一经度的不同纬度梯度上群落中物种多样性的变化趋向。试分析说明:
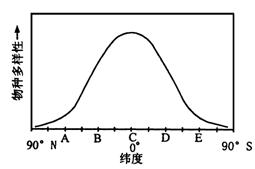
图15-8
(1)A地的生物多样性程度比B地________,造成这种差异的最主要的生态因素是____。
(2)有一种长日照植物(开花所需日照时间大于14小时)正在B地开花,则在D地同一种植物所处的状况不正确的是( )
A.开花 B.不开花 C.可能处于营养生长期 D.无法确定
(3)在B纬度线上有一坐高山,海拔约3500m,试问从山脚到山顶的植物分布特点类似于( )
A.A→B B.B→A
C.C→B D.D→C
(4)如果在C地区有一批木材,运到我国的B地区,必须办理( )
A.海运手续 B.陆运手续
C.通关手续 D.空运手续
(5)在 B地区的一批木材运到我国的 B地区,必须遵守严格的动植物检疫制度,目的是_____________________________________________________。
(6)在北半球的夏至这一天,B点的太阳高度角为_______________。
解析 这是一道将地理知识和生物知识综合起来的综合性测试题。
(1)在地球上,对生物的分布起决定性作用的是阳光,没有阳光就没有绿色植物,没有绿色植物就不会有其他的生物存在,但阳光对陆生生物而言不是主要的限制因子,在水域生态系统中也只是影响生物的垂直分布。影响生物分布、群落特点和生态系统类型的主要非生物因素是温度和水分(在水域生态系统中不是水分而是盐度)。在地球上热量分布的特点是:从南极到北极是逐渐增加,在赤道位置热量最高,后逐渐减少,所以温度的变化特点是:低→高→低。在不同纬度上的生物种类和数量的变化规律是:少→多→少。多样性指数的变化特点是:低→高→低。陆地生态系统在不同经度上的差异(如森林、草原、荒漠和沙漠等)是由于水分分布不均匀造成的。
(2)在一年中日照时间的变化是随纬度的不同而不同的。在夏季,北半球的纬度越高,日照时间越长,纬度越低,日照时间越短;在冬季的北半球与夏季正好相反。南半球的情况正好与北半球相反。长日照植物正在B地开花,说明B地正处于夏季,日照时间大于14个小时,此时南半球的D地应处于冬季,日照时间应小于12个小时,所以这种植物不可能在南北半球的中纬度地区同时开花。因题目中未说明这种植物是多年生还是一年生,是常绿还是落叶,所以B、C、D三种情况都有可能。
(3)植物群落在高山上的垂直分布是受温度的影响,温度随着海拔高度的增加而下降,一般每升高100米下降0.6℃~1℃。海拔越高,所以植物群落在高山上的垂直分布类似于植物在不同纬度线上的分布。所以正确选是B。
(4)C地处于赤道上,而在我国的最南端也是北纬4°左右。换句话说,C地肯定不在我国境内。C地的木材要运到我国的B地区,必须要经过海关的检查,属于我国进口木材的经济行为,所以必须办理通关手续。
(5)进口木材等农业产品必须经过海关的动植物检疫,目前是防止国外的一些危害性较大的昆虫生物侵入我国,对我国的生态平衡构成威胁,破坏我国的生态平衡。称为防止生态入侵。
(6)B点的纬度是北纬30°,在夏至这一天,太阳直射北回归线,所以北纬度30°地区的太阳高度角为(90°-30°)+23°26′=83°26′。
答案 (1)低,温度A地比 B地低;(2)A;(3)B;(4)C;(5)防止有害昆虫传入我国,破坏我国的生态平衡(或答防止生态入侵);(6)83°26′
|
| |
| 本周强化练习: | |
【能力训练】
1.“细菌冶练”是利用某些细菌的特殊代谢功能开采金属矿石,例如,氧化亚铁硫杆菌在溶液中能将黄铁矿氧化为Fe(SO4)3,并使溶液酸性增强,其过程如下:
黄铁矿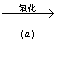 Fe2(SO4)3+能量
Fe2(SO4)3+能量
↓
6CO2+6H2O![]() C6H12O6
C6H12O6
(1)①从生物代谢看,b过程属____________作用。
②氧化亚铁硫杆菌的代谢类型应是_________
A.自养需氧型 B.异养需氧型 C.自养厌氧型 D.异养厌氧型
(2)写出(a)过程的反应方程式__________________。
(3)人们可利用Fe2(SO4)3作将氧化剂溶解铜矿石(Cu2S)然后加入铁屑进一步得到铜,请写出该反应的离子方程式:①___________;②_______________。
(4)工业上可用粗钢(含Zn、Ag、Au等)经电解制得(电解铜),电解过程中,粗钢接电源___________极,其电极反应式为___________,精铜接电源__________极,其电极反应式为_______________________。
(5)某工厂按(4)原理,平均每秒生产Amol精铜,(设阿伏加德罗常数为N,每个电子的带电量为e库仑),求电解槽中的平均电流强度为_____________。
2.(1)在地球诞生初期,死寂而缺氧的环境造就了一批“生灵”,它们不需要氧气便能呼吸,仅靠简单的碳酸盐、甲烷等物质就能维持生命。这种小生命生活在泥泞的沼泽和水草茂密的池塘里,它们叫菌,能够通过食用杂草、树叶、秸杆乃至垃圾等,然后呼出沼气,沼气的主要成分是_______________。
(2)沼气是一种廉价的能源,在农村中有大量的农作物秸杆、杂草等废弃物,在沼气中经微生物发酵之后,便可产生沼气,可以用来点灯、做饭。
①煤的主要成分是C,写出煤和沼气中的主要成分燃烧过程的化学方程式,并指出它们中哪一种燃烧对环境的污染少?
②该细菌的食料非常广泛,几乎所有的有机物都可以作沼气的发酵原料,如果有一个生产5×104t的酒精厂,把其全部酒精废液和废渣用来生产沼气,每年所得沼气完全燃烧 1×1015J的热量,若汽油燃烧值q=5.0×107J/kg,则这些沼气相当于_______kg汽油完全燃烧产生的热量,若把这些汽油用在发动机功率为P=1.0×106W的内燃机车上,机车以 108km/h的平均速度行驶,机车行驶____km。③若建立沼气发电站可以实现把_____能转化成电能,沼气被称为_______能源。
3.近年来,工业和城市迅速发展,大量的工业废水、生活污水以及垃圾、粉尘等物质不断地进入水体,水质受到污染的情况日益严重,如何避免污染,治理污染水已引起世界各国的高度重视。进入水体的无机有毒物主要是铜、镉、铬、砷、汞等重金属。有毒金属在自然界一般不易消失,通过食物链富集。由于农药DDT的使用,科学家们甚至在无人居住的南极企鹅体内发现了汞和五氢苯酚等杀虫剂的残留物。
请根据上述材料回答下列问题:
(1)南极大陆没有人类的生产活动,企鹅体内为何会有农药DDT的残留物?
(2)下面是甲、乙、丙、丁4个种群,在一个达到生态平衡的环境中所含有的总能量和残留农药DDT的平均浓度。
| 种群 | 甲 | 乙 | 丙 | 丁 |
| 能量(kJ) | 2.8×109 | 1.3×108 | 9.1×107 | 2.9×107 |
| DDT浓度(ppm) | 0.04 | 0.35 | 0.39 | 3.4 |
①这4个种群属于生产者的是____________________。
②写出这4个种群的能量流动的渠道__________________。
③在能量流动的渠道中___________越高,生物体内的DDT浓度也越高。
(3)某些工业废水(如造纸、皮革、食品、石油等)不经处理大量排入水体后,会使水中溶解氧缺乏,为什么?
(4)你估计一个湖泊中的氧浓度在什么时候和什么样的水质中最低( )
A.白天、未污染 B.黑夜、未污染 C.白天、污染 D.黑夜、污染
(5)植物营养物大量进入水体,导致水体富营养化。太湖是江苏省最大的淡水湖,近年来由于藻类生物疯狂繁殖,水质受到了严重的污染,破坏了生态平衡,影响了人民健康。如果需要在短时间内,大量减少藻类植物,采取下面哪一措施最有效( )
A.大量引入肉食性鱼类 B.大量引入吃鱼的浮游动物
C.完全除去吃浮游动物的鱼 D.完全除去肉食性鱼类
(6)造成水体富营化的主要因素是磷的大量进入。某洗衣店中的含磷酸盐废水经澄清池沉淀后排入附近湖泊,该废水带入水域中的磷酸盐是引起藻类生长的主要因素。
藻类生物的化学式为C106H263O110N16P,藻类生物与O2完全作用,可以生成CO2、H2O、NO3-、PO43-和H+。
①完成这一氧化还原反应方程式:
②由于洗涤剂Na5P3O10排入,导致水体富营养化,造成藻类(C106H263O110N16P)大量繁殖,从而消耗大量O2,设每天排入含30%(质量)三磷酸五纳的洗涤剂100kg,湖的面积为1km2,平均水深20m,湖水里O2的深度为9.1mg/dm3,多少天后湖里的溶解氧将被耗尽?
(7)某化工厂含有大量化学毒剂的污染水排入池塘中,造成池塘中的植物迅速死亡,试分析:
①对该生物生态系统中处于第二营养级的生物有什么影响?
②在图中15-9坐标中,用三条曲线表示处于不同营养级的生物在数量上的变化趋势,并注明各曲线名称。(生物数量值可任取)
③在以下坐标中,用一曲线表示分解者短期内数量上的变化趋势。
图15-9
4.被誉为改变未来世界十大新科技之一的燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,正以势不可挡之势挤入汽车工业和电力工业。它是一种不经过燃烧,将燃料的化学能直接转换成电能的装置。它主要由燃料、氧化剂、电极、电解质组成。在结构上与传统电池一样具有正负电极,正负电极被电解质分隔。它以还原剂(用氢作燃料,也可以添加一个氢气变换器,直接使用甲醇、天然气,甚至石油、柴油、煤等作燃料)为负极反应物,以氧化剂(如氧气、空气等)为正极反应物。为了使燃料便于进行电极反应,要求电极材料兼有催化剂的特性。可用多孔碳、多孔镍、铂、钯等贵金属以及聚四氟乙烯等电极材料。电解质则有碱性、酸性、熔融盐和固体电解质及高聚交换膜等数种。图15-10是一种氢——氧燃料电池的工作原理图。电角质为有机高分子聚合物,它不是传导氧离子而是传导质子H+,是通透质子的交换膜燃料电池。
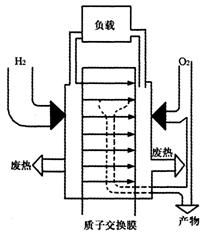
图15-10
(1)写出氢——氧燃料电池正负极发生的电极反应式。并注明是氧化反应还是还原反应。写出电池的总反应方程式。
燃料电源将燃料的化学能直接转换成电能,氢气和氧气源源不断地送入,反应连续不断地进行,于是在电池内产生了持续的电流。反应的生物是水,不会造成对环境的污染。燃料电池之所以能成为载人航天器的首选电池,另一个很重要的原因是相中了它生成的“废物”——水。这正好解决了宇航员在太空的饮水问题。当年美国“阿波罗11号”宇航飞船在长达8天的登月旅行中,3位宇航员的生活用水,来自于电池提供的水。
(2)若用燃料电池发电,输出电流的电流强度为A,则每小时能合成多少水?(已知阿伏加德NA=6.02×1023mol-1,电子的电量e=1.06×10-19C)
(3)电池燃料氢可利用甲醇、天然气、石油、柴油等燃料通过一个氢气变换器而得到。写出利用天然气转化为氢的化学方程式:_____________________。
(4)燃料电池在发电的同时还生成了水,这正好解决了宇航员在太空中饮水的问题。
①宇航员饮用合成水,通过消化系统,大部分在下列哪一处被吸收( )
A.口腔 B.消化道 C.小肠 D.大肠
②原生质中含量最多的化学成分是( )
A糖类 B.水 C.无机盐 D.蛋白质
③水通过自由扩散的方式出入细胞,这种运输方式不需要_____,也不需要_______。
④水在生物体中以______和_________两种形式存在。水既是________的重要组成部分,又是细胞内的__________。各种生物的生命活动,都是绝对不能离开水的。
⑤人体排泄水的途径主要有3条:(1)以尿的形式通过泌尿系统排出;(2)以______的形式经过__________排出;(3)以_________的形式经过________排出。
(5)请根据文中质子交换膜氢氧燃料电池工作原理图,说明负载的电流方向为______。
(6)如图15-11所示为千瓦级质子交换膜燃料电池组性能图谱,工作条件是:以H2和O2作为反应气体,控制电池温度为85℃,保持H2与O2压强分别为0.45 Mpa和0.50Mpa。
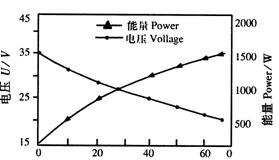
图15-11
根据该图回答下列问题:
①计算该电池组稳定后的内阻r大小约为多少?
②当输出电流大于40A时,电池输出功率范围_______________。
③当电池的输出功率为1kw时,相当于电动势为多少的普通电池。
(7)用某种燃料电池的电炉供电,设电炉的额定功率PO=400W,电池在不接负载的路端电压与电炉的额定电压相同,当电炉接到该电源上时,电炉实际消耗的功率P1=324W,若将两个这样的电炉并联接到该电源上,求两个电炉实际消耗的功率P2为多少?
5.“法轮功”宣扬了一整套荒谬的思想观点,宣称人类即将面临“毁灭”;宣扬“法轮功”拯救人类社会的惟一大法,李洪志编了一套“宇宙观”,他说“人都是从宇宙各个空间掉下来的,因为当他不符合那一层宇宙的法的要求的时候,那么他只能掉下来……掉到宇宙的中心——。地球是宇宙的一个垃圾站。”他妄谈生命起源,鼓吹人是神造出来的,宣扬鼓吹生老病死是“业力”的回报,大谈只有修炼才能成为“超常人”,结果许多修炼者盲目听信此言而贻误病情死去。
1999年7月,中共中央发出关于共产党员不准修炼“法轮大法”的通知,中华人民共和国民政部作出关于取缔法轮大法研究会的决定,公安部研究室发表了《李洪志其人其事》揭露了李洪志编造“法轮大法”和操纵“法轮功”组织腐蚀人们思想,扰乱公共秩序,破坏社会稳定的事实。
根据上述材料,回答下列问题:
(1)从天文学知识可知,地月系只是太阳系中的组成部分,比太阳系高一级的形体系统叫________系;___________系为最高一级天体系统,这是目前人们所能观察到的宇宙部分,在太阳系的九大行星中,按距离太阳由近至远排列,地球居第___________位。
(2)目前,关于生命起源是通过__________过程的说法已经为广大学者所承认,并认为这个进行过程可以分为________________;________________;__________________;__________________4个阶段。
(3)李洪志在某次带功报告上吹:“一次我拿一根纯铝棒经意念发功后,经高能物理研究所测试,铝棒的成分都发生了变化,变成了铁,还有铜和金的成分……”,试从能量和核变化角度分析其荒谬之处。
(4)如何从哲学的角度认清“法轮功”是伪科学。
6.图15-12表示制造啤酒的方法
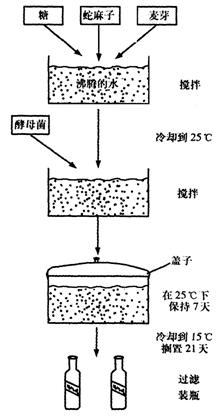
图15-12
(1)简要回答下列问题:
①为什么原料放入沸水中混合?
②为什么要在混合物中加入糖?
③为什么要在混合物冷却后才把酵母加进去?
④说出酶母菌细胞所进行的化学过程的名称。
⑤酶母比水更稠浓,但在化学反应中它会上升到混合的顶部,解释为什么。
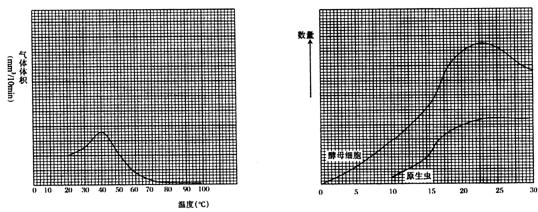
(2)两学生研究了发酵池中糖的作用,他们发现温度变化对气体体积产量的影响,他们在20℃温度下收集10分钟内放出来的气体体积,以后在不同温度下重复这样的测量。他们的记录结果在下表中示出:
| 温度(℃) | 气体体积(mm3/10min) |
| 20 | 10 |
| 30 | 25 |
| 40 | 35 |
| 50 | 20 |
| 60 | 8 |
| 70 | 2 |
| 80 | 1 |
| 100 | 0 |
①在图15-13中的方格纸上,用上列数据,画出一条光滑的曲线。
图15-13
②根据你制作的图,估计在45℃温度时,气体的生产率为_______mm3/10min。
(3)在一只盛有糖溶液的瓶中,加入酵母,以后的30天中混合物的变化情况在图15-14中示出。
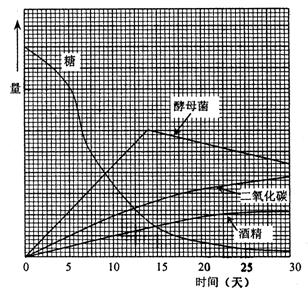
图15-14
用图的信息回答下列问题:
①酵母量在什么时候达到最大值?
②为什么酵母量停止增加下去,说出两种理由。
(4)该学生又准备了一瓶酵母和糖的混合液,10天以后,加进去一种吞食酵母的原生虫,图15-15示出11天以前酵母细胞和原生虫的数量变化,请继续画出第11天以后到 30天为止的两条曲线。
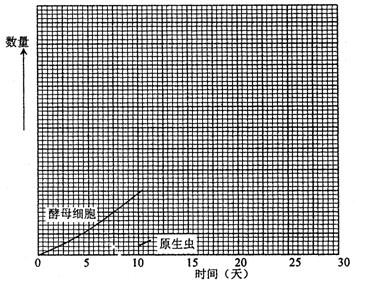
图15-15
7.每年6月5日定为“世界环境日”,从1972年开始,每年均由联合国环境规划署确定一个主题,开展“世界环境日”活动。其中关于水的主题:1976年是“水!生命的重要源泉”,1981年是“保护地下水和人类食物链,防止有毒化学品的污染”,可见水的重要性。
水污染有两类:一类是自然因素造成的,如地下水流动把地层中某些矿物溶解,使某些地区水体盐分。微量元素浓度偏高或因植物腐烂中产生的毒物而影响了当地的水质。另一类是人为因素造成的,主要工业排放的废水。此外,还包括生活污染水、农田排水、降雨淋洗大气中的污染物以及堆积在地上的垃圾经降雨淋洗流人水体的污染物。
水体污染物种类繁多,按照所造成的环境污染情况大体有以下几种类型:
①水体的富营养化及危害。
某些工业废水、施用磷肥和氮肥的农田及生活污水(有含磷增净剂的洗涤剂)中,都含有氮和磷,它们并非有害元素,而是植物营养元素,引起藻类及浮游生物的迅速繁殖。导致水中氧气大量减少而使水生生物因缺氧而大量死亡、腐败,致使水质恶劣化。
②需氧物质污染及危害。
生活污水、食品加工和造纸工业废水,含有糖、蛋白质、油脂、木质素等有机物;在石油的开采、储运、炼制及使用过程中,由于原油和各种石油制品进人环境。这些物质悬浮或溶解于污水中,经微生物的化学作用而分解,在分解过程中需要消耗氧气,因而被称为需氧污染物。这类污染物造成厌氧分解,产生恶臭(生成硫化氢、氨和硫醇等有难闻气味),使水质进一步恶化。
③酸、碱、盐等无机物污染及危害。
④重金属污染及危害。
污染水体的重金属有汞、镉、铅、铬、钒、钴、钡等。其中以汞的毒性最大,钢、铅、铬也有较大危害。
重金属在工厂、矿山生产过程中随废水排出,进入水体后不能被微生物降解。经食物链富集,能逐级在较高级生物体内千百倍地增加含量,最终进入人体。1955年~1972年日本富士山县神通川蜮。日本三人金属矿业公司锌铅冶炼厂排放含镉废水,污染神通川。两岸居民和矿工出现怪病,患者腰、膝关节疼痛,随后遍及全身,最后骨骼萎缩,饮水不进,在衰弱中疼痛而死亡。
请根据上述材料,回答下列问题:
(1)氮和磷等是生物体内的必须元素,而池塘中氮、磷含量过高,反而会引起富营养化而导致大量水生生物的死亡,请分析说明原因。
(2)水中的动植物尸体在微生物的分解下能产生出硫化氢、氨等难闻的气体,问这些物质主要来源于何种有机物。
(3)工业上为了处理含Cr2O72-离子的酸水,采用以下处理方法:
①往工业废水中加入适量的食盐。
②以铁作为阳极进行电解。
③鼓入空气。
经一段时间后,使废水中含铬量降到可排放的标准。
请用已学过的化学知识解释处理含Cr2O72-的工业废水的原因。
注:Fe(OH)3开始沉淀的pH值为2.7,沉淀完全的pH值为3.7。Fe(OH)2开始沉淀的pH值为7.6,沉淀完全的pH值为9.6,并且Fe(OH)2呈絮状,不易从溶液中除去。
(4)测定污水中Cr2O72-的含量,可以用(NH4)2Fe(SO4)2作为还原剂,采用适当的指示剂,对污水进行滴淀,若量取10.00mL污水,用0.0100mol/L的(NH4)2Fe(S4)2。滴定,其共用去(NH4)2Fe(SO4)2溶液12.00mol。已知Cr2O72-在酸性溶液中作氧化剂时,被还原成Cr3+。
①写出 K2Cr2O7与刚(NH4)2Fe(SO4)2在H2SO4存在下反应的化学方程式。
②计算污水中K2Cr2O7的物质的量浓度。
8.太阳是银河系中极为普通的一颗恒星,剧烈的热核反应使之不断地向外辐射能量。太阳辐射的能量绝大部分集中在紫外波段、可见光波段和红外波段,它们的能量分别占总辐射的9%、44%和47%。
地球的大气层中,基本不变的成分为氧、氮、汤等,占大气总量的99.6%,可变气体成分主要有CO2、水汽和臭氧等,这些气体的含量极小,但对大气物理状况的影响极大。
大气臭氧层一般是指高度在离地面10~25km的大气层,其中臭氧的深度很低,将其折合成标准状态,其总累积厚度也不超过0.3cm,其含量虽小,但对地球上的气候和生物影响很大。
(1)大气压强P随距地面高度Z的增大而减小,经验公式为PZ=PO·e-Z/8000,其中PO为地表的气压值,e=2.718。若臭氧层集中在24km的高空处,设在该高处的温度为-50℃。试估算臭氧层的厚度。
(2)简要说明臭氧层对地球生物圈的意义。
(3)臭氧的生消可以简化如下的反应方程:高空大气中的一个重要的光化学反应是氧分子呼吸太阳辐射中波长![]() <0.24
<0.24![]() m的光子,离解为氧原子,即
m的光子,离解为氧原子,即
O2+hv(![]() <0.24
<0.24![]() m=→O+O
m=→O+O
由此可见形成一系列的反应,其中最重要的氧原子和氧分子在第三体(M)的参与下形成臭氧,其反应方程为____________。
这里的M主要是氧原子或氮分子,它们在反应过程中同时满足能量守恒和动量守恒所必需的。
臭氧在![]() <0.18
<0.18![]() m的辐射作用下,能离解成氧分子和氧原子,其反应方程式为:
m的辐射作用下,能离解成氧分子和氧原子,其反应方程式为:
_____________________________________。
(4)人类的活动所产生的一些气体,能对大气中的臭氧起到破坏的作用。使其含量减少,将造成严重后果,直接威胁到人类的生活和生存。这些年来,屡有在南极或北极,甚至在西藏出现臭氧黑洞的报道,引起人们极大的关注。
简要说明人类活动产生的哪些气体对大气臭氧层能起破坏作用。
(5)人类大量燃烧矿物放出大量CO2,使大气中的CO2浓度不断增加,这将对人类造成哪些后果?
9.原子里具有相同质子数和不同中子数的同种元素的原子互称同位素。“同位”之意,是他们在元素周期表中共同占有一个位置。
同位素这个概念是1913年由英国科学家索迪(1877~1956年)提出的。当时由于放射性元素的发现,在研究放射性元素的性质时,观察到有些放射性不同的元素,尽管它们的原子量各不相同,而化学性质却完全一样。如铀有原子量为234、235、238等多种放射性元素。同种元素的各种同位素虽然质量数不同,但它们的化学性质几乎完全相同。在天然存在的某种元素里,不论是游离态还是化合态,各种同位素所占的原子百分比一般是不变的。同位素原子在许多方面有着广泛的应用。
请根据上述材料,回答下列问题:
(1)1934年,科学家在用![]() 粒子轰击铝箔时,除探测到预料中的中子外,还探测到了正电子,更意外的是,拿走
粒子轰击铝箔时,除探测到预料中的中子外,还探测到了正电子,更意外的是,拿走![]() 放射源后,铝箔虽不再发射中子,但仍继续发射正电子,而且这种放射性随时间衰减的规律跟天然放射性一样,也有一定的半衰期。
放射源后,铝箔虽不再发射中子,但仍继续发射正电子,而且这种放射性随时间衰减的规律跟天然放射性一样,也有一定的半衰期。
①写出![]() 粒子轰击铝箔(
粒子轰击铝箔(![]() )产生中子的核反应方程式,并说明与普通的化学反应式的本质区别。
)产生中子的核反应方程式,并说明与普通的化学反应式的本质区别。
②上述产生具有放射性的同位素叫做放射性同位素,写出其产生正电子的核反应方程式。
③简要说明放射性同位素的应用,并至少举出两个实际应用的例子。
(2)已知B有种同位素,分别为![]() 、
、![]() ,B元素的相对原子质量为10.8,列式计算
,B元素的相对原子质量为10.8,列式计算![]() 把占B元素的质量分数?
把占B元素的质量分数?
(3)用CH3COOH与H18OC2H5。在酸催化下发生酯化反应,18O对最后存在于哪种产物中?
在2SO2
+O2![]() 2SO3的可逆反应达平衡后,充分
2SO3的可逆反应达平衡后,充分![]() 18O2,问过一段时间重新建立平衡后,18O存在于哪些物质中?
18O2,问过一段时间重新建立平衡后,18O存在于哪些物质中?
(4)用32P中标记噬菌体的DNA,侵染细菌后32P可出现在( )
A.噬菌体残留的外壳中 B.细菌的残体内
C.全部子代噬菌体内 D.极少数子代噬菌体内
(5)现在从生物体内提取一个DNA分子和标记了放射性同位素3H的4种脱氧核苷酸,要在实验室合成新的DNA分子:
①合成新的DNA分子除上述物质外,还需要_________等。
②在合成的两个子代的DNA分子中,每个DNA都含有______条含3H的脱氧核苷酸链。
(6)放射性同位素的蜕变反应速度为 2.303lg![]() =kt
=kt
其中:CO为放射性物质的初浓度,C为某一指定时刻的浓度,t为反应所经历的时间,k为速度常数,单位为(时间)-1。在蜕变反应中,反应物消耗一半(或反应物减少到初始浓度的一半)所需要的时间称为半衰期,利用放射性元素的半衰期可以确定岩石、古代动植物化石的“年龄”。
碳的放射性同位素14C在自然界树木中的分布基本保持为总碳量的1.01×10-13%。某考古队在一山洞发现一些古代木头燃烧的灰烬,经分析14C的含量为总碳量的9.87×10-15%,已知14C半衰期为5700年,试计算灰烬距今约多少年?
10.阅读下列材料后回答问题。
材料1
酸雨是英国化学家R·A·Smith于1872年最先提出的,一般是指pH值小于 5.6的雨、雪、雾等大气降水,是大气污染的表现。酸雨被称作“空中死神”。据某市区1998年环境状况公报载,市区酸雨频率为41.3%,比上年上升了5.5个百分点。降水年平均值为4.87,降水酸性污染较严重,表现为煤烟型污染特征。
材料2
①某地一场较大范围的酸雨,植物叶面遭腐蚀,产生大量斑点而坏死,导致西瓜大面积绝产,损失惨重。
②酸雨使植物阳离子从叶面析出。使钙、镁、铁等离子迅速从土壤中损失,土壤营养状况降低。还使光合作用受到抑制,影响植物生长。
③铝对生物来说是有害元素,土壤中以氧化铝存在,pH=5.6时,几乎不溶解,当pH值为4.6时,铝的溶解度增加100倍,并转化成硫酸铝,造成树木死亡。四川某林场,华山松死亡率达96%,就是酸雨使土壤中硫酸铝浓度增高,危及华山松。
材料3
某校科技小组同学采集酸雨样品,每隔一段时间测定pH值,得到下列数据:
| 时间 | 开始 | 8小时 | 16小时 | 24小时 | 32小时 | 40小时 | 48小时 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
请依据材料回答:
(1)酸雨的形成是由于工业生产过程中大量矿物燃料的使用,使空气中_______气体较多,与降水结合产生,请写出酸雨形成的反应方程式______________________。
(2)酸雨对高等植物的影响,他表现在哪几个方面?
A.___________________________________________________,
B.___________________________________________________,
C.___________________________________________________。
(3)大气污染,一方面影响动植物生长,另一方面对人类___________系统危害最大,影响呼吸过程的 ,常见疾病有__________________。
(4)解释酸雨放置时,pH变化的主要原因。
(5)写出pH变化的离子方程式。
(6)根据所学的生物、化学知识,对该市的酸雨防治提出合理化建议(至少3条)。

参考答案
能力训练
1.(1)①化能合成;②A;
(2)4FeS2+15O2+2H2O=2Fe2(SO4)3+2H2SO4;
(3)①4Fe3++Cu2S=4Fe2++S↓;②Fe+Cu2+=Fe2++Cu
(4)正,Cu-2e-Cu2+,负,Cu2++2e=Cu;(5)Ane
2.(1)甲烷
(2)①C+O2=CO2,CH4+O2=CO2+2H2O,1molC和1molCH4燃烧产生的CO2都是1mol,而C的摩尔质量小于CH4的摩尔质量,所以燃烧相同质量是C产生的CO2多,并且产生大量废渣对环境污染较大,甲烷对环境污染少。②m=Q/q=2×107 3×107(提示:W=Pt,t=w/p=109S,s=vt=108×109/3600=3×109kg) ③生物 新
3.(1)被DDT污染的水进入海洋,通过海洋食物链的传递进入南极企鹅体内,说明物质循环带有全球性
(2)①甲 ②见右图 ③营养级
(3)造纸、皮革、食品、石油厂排出的废水是有机物,排入水中会被微生物分解,微生物分解机物的过程将消耗大量氧,使水中溶解氧缺乏
(4)D
(5)C
(6)①C106H263O110N16P+138O2=106CO2+122H2O+16NO3-+PO43-+19H+ ②169天后湖水中的氧将被耗尽(提示:由于洗涤剂(Na5p3O10)排入,导致水体富营养化、造成藻类(C106H263O110N16P)大量增殖,从而消耗气。 由于1molNa5P3O10→3molC106H268O110N16P→138×3molO2,所以每天耗氧量no2=![]() ×138×3,mp2=n02×Mo2=
×138×3,mp2=n02×Mo2=![]() ×138×3×32=1.08×106g/d,湖水总含氧量:m02=9.1×10-3×106×20×103=182×106g,则182×106÷1.08×106g/d=169d (7)①生产者大量死亡使初级消费者食物短缺而大量死亡
×138×3×32=1.08×106g/d,湖水总含氧量:m02=9.1×10-3×106×20×103=182×106g,则182×106÷1.08×106g/d=169d (7)①生产者大量死亡使初级消费者食物短缺而大量死亡
4.(1)负极:H2-2e=2H+(氧化反应);正极2H++1/2O2+2e=2H2O(还原反应)或4H++O2+4e=4H2O,总反应方程式为H2+1/2O2=H2O或2H2+O2=2H2O
(2)193.3g(提示:电量Q=h=533A×3600s=1.9188×106C,电路上通过电子数=![]() =1.20×1025,电子的物质的量=
=1.20×1025,电子的物质的量=![]() 19.93mol。根据电极反应式,生成水的物质的量为199.3mol÷2=9.965mol,生成水的质量=9.965mol×19g·mol-1=179.3g。)
19.93mol。根据电极反应式,生成水的物质的量为199.3mol÷2=9.965mol,生成水的质量=9.965mol×19g·mol-1=179.3g。)
(3)CH 4+H2O一定条件3H2+CO;CO+H2O一定条件H2+CO2
(4)①C ②B ③耗耗细胞内新陈代谢的能量 载体蛋白来协助 ④结合水和自由水 细胞结构 良好溶剂 ⑤(2)汗液 皮肤 (3)气体 呼吸系统
(5)从右到左(提示:因为氢失去电子,电子从左向右通过负载)
(6)①r=0.1Ω(提示:在平直线段上选取两点(I1、U1)、(I2、U2),列方程:U1+I1r=U2+I2r,可解出r)②>1kw③≈30.7V(提示:从图15—11查出P=1kw时,I≈37A,则U=P/I≈27V,代入ε=U+Ir=30.7V。) (7)P2=536W(提示:设内阻r,由 P1/P0=324/400,可知U1/U0=0.9,又因为Ur=U0-U1、Ur/r=U1/R,所以r/R=1/9,并联后;Ur1=U0-U2,Ur/r=U22R,Ur1=U0-U2,所以,Ur1/U2=2/9、U2=9/11U0、P2=2U22/R=536W。)
5.(1)银河系 总星 三
(2)化学进化 从无机小分子物质生成有机物小分子物质 从有机小分子形成有机高分子物质 从有机高分子物质组成多分子体系 从多分子体系演变为生命
(3)铝原子要变成铁原子须通过核聚变,发生核聚变需要很大的能量,因此人体不可能提供那么巨大的能量是使铝变为铁,因而李洪志的说法是荒谬的
(4)“法轮功”宣扬的是伪科学。“法轮功”的自然观是唯心主义的。现代科学的发展用大量事实说明,人的产生是一个漫长的、客观的自然演化和进化过程,是物质世界矛盾运动达到一定程度的产物。“法轮功”宣扬人是神创造的,这是荒谬的。“法轮功”的历史观是唯心主义的。唯历史观认为,人民群众是历史的创造者,世界上从来没有救世主,而“法轮功”能拯救人类。“法轮功”的宇宙观是反唯物辩证法的。唯物辩证证法认为,世界是无限发展变化的,不仅在时间上,而且在空间上也是无限的,而“法轮功”却胡编了一套“宇宙观”,认为地球是宇宙的中心,地球是宇宙的一个垃圾站
6.(1)①消毒杀菌(即将其他的微生物杀死,防止霉菌等微生物的生长)②干酵母中的酵母菌刚恢复活力时还不能或很难利用淀汾,加入糖可使干酵母很快恢复活力③防止酵母菌被高温杀死④在有氧条件下进行有氧呼吸,并繁殖菌体;在无氧条件进行无氧呼吸,产生酒精⑤因为酵母菌进行有氧呼吸获得的能量多,所以酵母菌上升到混合物的顶部是为了获得更多的氧气。
(2)①如左下图
②30 (3)①14天 ②糖耗尽,营养缺乏,种内竞争加剧,出生率下降,死亡率上升,当死亡率与出生率相等时,酵母菌数量就不再上升;氧气耗尽,酵母菌不能进行有氧呼吸,就不能进行繁殖,所以种群数量不再增加;酒精含量的增加使酵母的生存环境变得恶劣,酵母菌受自身代谢产物的抑制而限制种群数量的增加(三者中答对二点即可) (4)如右上图
7.(1)氮、磷、钾为植物生长必需的元素,营养丰富必然引起藻类及浮游生物、水下植物的迅速繁殖。从光合作用的角度分析,植物吸收二氧化碳,而释放出氧气,按量水中的溶解氧会增加。但藻类的寿命短,繁殖周期短,在藻类大量繁殖的时候,也有大量的藻类死亡,藻类的大量死亡导致水中的有机物增加,需氧型细菌也相应增加,需氧型细菌的活动消耗掉水中大量的氧气,所以水中的溶解氧大量减少,导致水生生物因缺氧而大量死亡、腐败,致使水质恶化。
(2)动植物的组成主要是蛋白质、脂肪、纤维素、淀粉、水及少量无机盐。纤维素和淀粉属于糖类,可由单糖脱水缩聚而成,是碳水化合物,组成元素只有碳、氢、氧、脂肪属脂类,是醇和酸经酯化反应生成的产物,所以组成元素主要是碳、氢、氧,只有极微量的氮和磷等元素。蛋白质是氨基酸经肽键综合而成,其组成中氮元素含量较大,有些蛋白质也会有硫元素,在微生物作用下,发生脱氨等反应,生成氨气及硫化氢,所以难闻气味的主要来源是蛋质。
(3)解答本题涉及到化学知识:
①对氧化一还原应、电解池的原理的理解和应用。电解池的电极分为惰性电极和金属电极。若用石墨、铂做电极,溶液中阴—阳离子的放电顺序为:阳离子:K+、Na+、Mg2+、Al3+……Zn2+、Fe2+……H+、Ca2+、Fe3+Ag+和金属顺序表正好相反,金属的还原性越强,其对应的阳离子氧化越弱。 阴离子:S2-、I-、Br-、CI-、OH-非含氧酸根离子顺序递减。而从属做阳极,则金属发生失电子的氧化反应。
②电解过程溶液pH值的变化以及pH值变化对沉淀的影响
③廉价化工原料的选择,不断鼓入空气的原因
④离子方程式的书写
⑤物质分离方法的选择 选择铁做阳极:以Fe阳极,电极反应式为:阳极Fe-2e=Fe2+,阴极2H++2e=H2↑ 加入少量食盐,是增加污水中离子浓度,增强导电能力。以生成的Fe2+还原剂,在酸性溶液中与Cr2O72-离子发生氧化还原反应,离子方程式:6Fe2+=Cr2O72-+14H+=6Fe3++2Cr3+7H2O 这样Cr2O72-离子被还原成Cr3+。在 电解过程中,由于H+在阴极不断放电,失破了水的电离平衡,促进水的电离,溶液的pH值上升,溶液中的阳离子以Cr(OH)3、Fe(OH)2、F e(OH)3形成沉淀。由信息可知,Fe(OH)2开始沉淀的pH值为7.6,沉淀完全的pH值为9.6,并且Fe(OH)2呈絮状沉淀不便分离,不易从溶液中除去。根据已学的知识,Fe(OH)2开始沉淀的pH值为7.6沉淀完全的pH什为9.6,并且Fe(OH)2呈絮状沉淀不便分离,不易从溶液中除去。根据已学的知识,Fe(OH)2极易被氧化,所以在处理过程中鼓入空气,让空气中O2充分与Fe(OH)2反应:4Fe(OH)2+O2+2H2O=4Fe(OH)3↓。成为容易分离
的Cr(OH)3、Fe(OH)3,使废水含铬量降到可排放标准。
(4)①K2Cr2O7+6(NH4)Fe(SO4)2+7H2SO4=K2SO4+Cr2(SO4)3+3Fe2(SO4)3+6(NH4)2SO4+7H2O
②2×10-3mlo/L 提示:本题看似一个复杂的氧化还原反应方程式,裨上只有一种元素被氧化,一种元素被还原,是一种简单的氧化还原反应。还原剂中 Fe2+:2+→+3-e 氧化剂中Cr2O72-中Cr:+6→+3+3e 即每摩尔 Cr2O72-中得6mol电子
。![]() =6Fe3++2Cr3+先由电子得失守恒配平氧化被还原的元素。再用观察法配平其他元素,化学方程式即可配平。由物质的量浓度公式c=
=6Fe3++2Cr3+先由电子得失守恒配平氧化被还原的元素。再用观察法配平其他元素,化学方程式即可配平。由物质的量浓度公式c=![]() 6(NH4)2Fe(SO4)2求出Cr2O72-的物质的量。由化学方程式
6(NH4)2Fe(SO4)2求出Cr2O72-的物质的量。由化学方程式
6(NH4)2F3(SO4)2~K+Cr2O7
6mol 1mol
12×12-3×-2mol c×10-2mol
c=2×10-3mol/L
8.(1)标准标态:一个标准大气压,温度273K。由题目给出的公式Px=PO·e-x/8000,可得Z=24km。高空处的气压PZ=0.05P0,设PO为标准大气压。根据气态方程![]() =
=![]() ,可得在Z=24km高空处,臭氧层的厚度D=5cm。
,可得在Z=24km高空处,臭氧层的厚度D=5cm。
(2)适量照射紫外线对人体有益,可促进骨骼的钙化,预防佝偻病,紫外线还能提高机体的抗菌能力。但过量照射紫外一会破坏生物蛋白质和基因物质,造成细胞死亡;会使皮肤产生红斑、色素沉着、皮肤癌发病率增多;可伤害眼睛,引起急性角膜炎、白内障和失明。臭氧层对紫外线有吸收作用,能阻挡高能量的紫外线辐射到地表,对地球的生物起到保护作用。因此,臭氧层的存在对地球的生物至关重要。
(3)O2+O+M→O3+M O2+hv(![]() <0.18
<0.18![]() m=→O2+O
m=→O2+O
(4)人类活动中产生的氮氧化物和氟利昂等气体对臭氧层有破坏作用。喷气飞机排放大量的NO,一些农药、杀虫剂等能排放NO2,作为制冷剂中广泛使用的氟利昂等。
(5)CO2气体对红外辐射有强烈的吸收作用,若大气中含有较多的CO2,可把大部分地表的红外辐射吸收掉,使大气的温度升高,造成“温室效应”。
9.(1)①![]() +
+![]() →
→![]() +
+![]() 与普通化学方程式的区别是:普通化学反应原子核不变,而核反应过程中原子核发生了变化 ②
与普通化学方程式的区别是:普通化学反应原子核不变,而核反应过程中原子核发生了变化 ②![]() →
→![]() +
+![]() ③放射性同位素的应用主要分两类:一是利用它的射线;二是做示踪原子。例如,利用葳60放出的很强的
③放射性同位素的应用主要分两类:一是利用它的射线;二是做示踪原子。例如,利用葳60放出的很强的![]() 射线来检查金属内部有没有砂眼或裂纹,这叫
射线来检查金属内部有没有砂眼或裂纹,这叫![]() 射线探伤。在农业施肥的肥料中加一些放射性同位素,就会知道哪种农作物在什么季节最能吸收含哪种元素的肥料。另外,在生物学研究方面,同位素示踪技术也起着十分重要的作用。
射线探伤。在农业施肥的肥料中加一些放射性同位素,就会知道哪种农作物在什么季节最能吸收含哪种元素的肥料。另外,在生物学研究方面,同位素示踪技术也起着十分重要的作用。
(2)先求出摩尔比![]() 为
为![]() ,则105B元素的质量分数为
,则105B元素的质量分数为![]() =0.23
=0.23
(3)18O最后存在于酯中 18O存在于所有物质中(SO2、SO3、O2中)
(4)D
(5)①磷酸、含氧碱基 ②1
(6)19381年(提示:由半衰期求k,当C=![]() CO时,t=
CO时,t=![]() ,代入速率方程;2.3031 1g
,代入速率方程;2.3031 1g![]() =kt1/2,(t1/2=5700),k=1.216×10-4年-1,根据14C浓度比变化,2.3031g
=kt1/2,(t1/2=5700),k=1.216×10-4年-1,根据14C浓度比变化,2.3031g![]() =1.216×10-4t,将CO=1.10×10-13%,C=9.87×10-15%代入,得t=19831(年)
=1.216×10-4t,将CO=1.10×10-13%,C=9.87×10-15%代入,得t=19831(年)
10.
(1)SO2、氮化合物 2SO2+O2=2SO3,NO+SO2+O2=NO2+SO3, SO3+H2O=H2SO4, 3NO2+H2O=2HNO3+NO
(2)A.抑制植物光合作用,影响植物生长(影响光合作用) B.影响植物的矿质代谢 C. 有害元素毒害,导致植物死亡
(3)呼吸 外呼吸 咳嗽、哮喘、肺气肿(或呼吸系统疾病)
(4)雨水样品中H2SO4和SO2不断被空气中氧气氧化生成强酸H2SO4,所以pH值随时间延长,H+浓度增大,pH值下降,至全部氧化后,溶液中形成H2SO4,不会氧化和挥发,pH值不再变化。
(5)2SO2+2H2O+O2=4H++2SO42-或2H2SO3+O3=4H++2SO42-
(6)
A.抑制污染源(或治理污染源,达标排放)
B.寻找洁净能源
C.改进工艺流程(如烟气脱硫)
D.大力开展绿化,如适当栽种柳杉等
E.使用无铅汽油,逐步淘汰燃油助力车
F.微生物脱硫(源头治理)
G.加强环境管理 (只要答出其中3点即可得满分)


