试卷类型:A
2003年MAM高考理综仿真试题(六)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1至5页,第Ⅱ卷第6至12页。满分为300分,考试时间为150分钟。
第Ⅰ卷(选择题 共132分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
一、选择题(本题共22小题,每小题6分,共132分,每小题的四个选项中只有一项符合题意)
1.食品分类学家将食品分为绿色食品、蓝色食品、白色食品等,绿色植物通过光合作用转化的食品叫绿色食品,海洋提供的食品叫蓝色食品,通过微生物发酵的食品叫白色食品。下列属于白色食品的是
①面粉 ②菜油 ③食醋 ④海带 ⑤红葡萄酒 ⑥苹果
A.①⑥ B.③⑥ C.③⑤ D.⑤⑥
2.与动物细胞中进行有氧呼吸、纺锤体的形成及胰岛素的合成有关的细胞器是
①线粒体 ②高尔基体 ③中心体 ④核糖体
|
|
程中CO2被还原为有机物,所需的还原剂在何种细胞器哪一部分形成
A.叶绿体的内部结构 B.线粒体基质
C.内质网膜 D.叶绿体基质
4.在金鱼藻中,花色由一对等位基因决定,其中R决定红色,r决定白色;叶形由另一对独立遗传的等位基因控制,N决定狭形叶,n决定宽叶。让RRnn×rrNN杂交:F1代为粉红花中宽叶,F1自交,下列的F2代表现型中,出现概率最小的类型是
A.红花中宽叶 B.白花中宽叶
C.粉红花狭叶 D.红花狭叶
5.在一个处于平衡的池塘生态系统中,由于持续排入了大量的生活污水而变成了又黑又臭的水塘,下面是有关这个池塘生态系统在崩溃过程中的一系列变化,请根据下列所列的内容,判断下列变化顺序,哪一组是正确的
①好氧性细菌大量增加
②水生动植物全部死亡
③水中含有大量的有机物
④氧容量下降
⑤厌氧型细菌数量增加
⑥水生生物大量死亡
⑦氧耗尽
⑧好氧性细菌大量增加
⑨有机物分解不彻底
⑩水中有机物大量增加
A.①③④⑧⑩⑤②⑦⑥⑨
B.③①④⑥⑩⑧⑦②⑤⑨
C.③①④⑩⑧⑤②⑦⑥⑨
D.①④⑥②⑧⑩③⑤⑦⑨
6.下列科学家中,为我国化学工业做出重大贡献的是
A.邓稼先
B.李四光
C.华罗庚
D.侯德榜
7.常见的污染物分为一次污染物和二次污染物。二次污染物是排入环境中的一次污染物在物理化学因素或微生物作用下,发生变化所生成的新污染物。如反应2NO+O2=2NO2中,二氧化氮为二次污染物。下列3种气体:①硫化氢 ②二氧化硫 ③汽油,其中能生成二次污染物的是
A.①②
B.②③
C.①③
D.①②③
8.为证明在食盐中存在所加的“碘剂”,可用试纸和一些生活中常见的物质进行检验。在可供选用的物质:①自来水 ②蓝色石蕊试纸 ③碘化钾 ④淀粉 ⑤食盐 ⑥食醋 ⑦白酒,实验时必须使用③⑥,此检验中所发生的离子反应中阳离子的化学计量系数为
A.1
B.3
C.5
D.6
9.在石墨晶体中,每一层由无数个正六边形构成,同一层内每个碳原子与相邻的三个碳原子以C—C键结合。则石墨晶体中碳原子数与C—C键之比为
A.1∶1
B.2∶1
C.2∶3
D.3∶2
10.将一定体积的空气通入吸收剂,测定其导电的变化,这种方法可以测定空气中污染物的含量。如测定硫化氢的含量,用硫酸铜溶液吸收,可测定很大浓度范围的硫化氢,但电导变化不大。用溴水吸收,仅适用于较小浓度范围,但有很高的灵敏度。现既要兼顾吸收量又要兼顾灵敏度,则测定空气中氯气的含量,最好选用的吸收剂是
A.KI溶液
B.溴水
C.Na2SO3溶液
D.NaOH溶液
11.某有机物可看作是甲烷分子中的4个氢原子被4个苯基取代后的产物,下列关于此有机物的说法正确的是
A.分子组成是C25H20
B.该有机物属于烃的衍生物
C.分子中所有原子可处于同一平面
D.它的一氯取代物只有一种
12.下列关于金属腐蚀叙述正确的是
A.金属在潮湿情况下的腐蚀实质是 M+nΗ2O=M(OH)n+n/2H2↑
B.金属的化学腐蚀实质是 M-2e=Mn+,电子直接转移给氧化剂
C.金属的化学腐蚀必须在酸性条件下进行
D.在潮湿的中性环境中,金属的腐蚀主要是化学腐蚀
13.为了使Na2S溶液中![]() /CS2-的比值变小,可加入的物质是
/CS2-的比值变小,可加入的物质是
A.适量盐酸
B.适量NaOH溶液
C.适量KOH溶液
D.适量NaHS溶液
14.在硫酸铁溶液中,加入a g铜,完全溶解后,又加入b g铁,充分反应后得到c g残余固体,且a>c,则下列判断正确的是
A.最后得到的溶液中含有Fe3+、Cu2+、Fe2+
B.残余固体为铁、铜混合物
C.最后得到的溶液中一定不含Fe3+、Cu2+
D.残余固体全部是铜
15.下列说法正确的是
①医院外科手术室里的无影灯,是光的衍射现象的应用
②光导纤维传递光信号的物理原理是光的全反射
③沙漠上的“蜃景”是由于光的折射和全反射形成的
④晚上,人们看到天上的星体位置总比它的实际位置高
A.①②
B.③④
C.②③④
D.①②③④
16.原子序数大于92的所有元素都能自发地放出射线,这些射线共有3种:α射线、β射线、γ射线,下列说法中正确的是
A.原子核每放出一个α粒子,原子序数减少4
B.原子核每放出一个α粒子,原子序数增加4
C.原子核每放出一个β粒子,原子序数减少1
D.原子核每放出一个β粒子,原子序数增加1
17.某同学身高1.8 m,在运动会上他参加跳高比赛,起跳后身体横着越过了1.8 m高的横杆,据此可估算出他起跳时竖直向上的速度大约为(取g=10 m/s2)
A.2 m/s
B.4 m/s
C.6 m/s
D.8 m/s
18.2001年3月23日,“和平”号空间站运行到离地高为h(约200 km)的轨道上时采用三次点火减速,最后成功地坠毁于南太平洋预定海域。设地球半径为R,地面附近重力加速度为g,且空间站运动的轨道近似为圆轨道,则它在离地面h处运行时速度大小为
A.![]()
B.![]()
C.![]()
D.![]()
19.粗糙的地面上放着一木块,子弹水平地射进木块后停留在木块中,带动木块一起向前滑动一段距离。在这一过程中,子弹和木块组成的系统
A.动量守恒
B.能量守恒
C.动量不守恒
![]() D.机械能守恒
D.机械能守恒
20.如图所示,S为上下振动的波源,它所激起的波向右传播,波长为4 m,已知SA=3 m。当S通过平衡位置向上振动时,A质点的位置是
A.在波谷
B.在波峰
C.在平衡位置
D.无法判定
21.把一电热器接到110 V的直流电源上,在时间t内产生热量Q,若将它接到u= 110sinωt V的交变电源上,仍要产生Q的热量,则所需要的时间为
A.2t
B.![]() t
t
C.t
D.4t
22.在彩色电视机的电源输入端装有电源滤波器,其电路图如下图所示。主要元件是两个电感线圈L1、L2,它们的自感系数很大,F是保险丝,R是灵敏电阻(正常情况下阻值很大,但电压超过设定值时,阻值会迅速变小,可以保护与其并联的元件),C1、C2是电容器,S为电视机开关。某一次用户没有先关电视(即没断开S)就拔掉电源插头,结果烧坏了图中电路元件,可能被烧坏的元件是:
①C2 ②C1 ③L1或L2 ④F
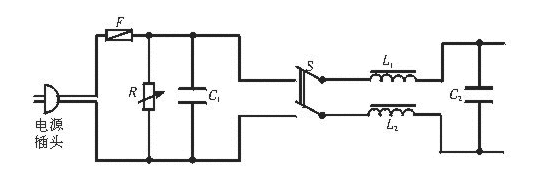
A.①③ B.①④ C.②④ D.②③
第Ⅱ卷(非选择题 共168分)
注意事项:
1.第Ⅱ卷共7页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
| 题号 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | 32 | 33 | 34 | Ⅱ卷总分 |
| 得分 |
23.(18分)农业上施用大量的含氮的化肥,是北方冬小麦获得小麦高产的重要措施之一,请回答下列问题:
(1)施入土壤中的氮素化肥主要以_______________形式被小麦根部吸收,其吸收方式主要经过_____________和_____________两个过程。
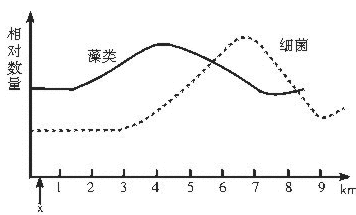
(2)施肥后要灌溉,从麦田中流失的水,若从上图x处注入一条河流中导致水体中藻类,数量发生变化,如图曲线表示,请回答:
在x位置下游,藻类大量增加的原因是________________________,在下游3~6 km河段细菌数量迅速增加的原因是_____________________________________。
(3)试分析,如果其他条件不变,预计在x下游_____________km至_____________km河段中,生活的鱼类数量减少,其原因是_____________________________________。
24.(18分)有人在饲养蝌蚪时,做了如下实验:
①取玻璃缸三只,分别标上A、B、C,各放入清水200 mL和少量的水草, 每缸内各放5只大小相似的小蝌蚪。
②在A缸内每天加入5 mg甲状腺制剂,B缸内每天加甲硫咪唑(甲状腺抑制剂)5 mg,C缸内不加药物,同时三缸每天加饭粒少许,连续7天。
③观察三缸中蝌蚪的体长、四肢、尾的变化,每天记录一次。
问:
(1)预期三缸中的蝌蚪,最先长出四肢的是_________缸。7天后,尾最长的是_________缸中的蝌蚪。
(2)如结果与预期相符,则说明_________。
(3)实验中C缸的作用是_________。如C缸的水中缺少碘,则其蝌蚪变化更像A缸还是B缸?_________。原因是______________________________。
25.(9分)某课外活动小组拟用下列步骤测定植物种子的呼吸作用释放的CO2。
a. 按下图装好实验装置。
b. 向250 mL的锥形瓶中加入20.0 mL 0.02 mol/L Ba(OH)2溶液
c. 称取刚萌发的小麦种子W g,装于尼龙小篮内,并塞紧瓶塞
d. 每10 min 左右,轻轻摇动锥形瓶
e. 1小时后,打开瓶塞,取出小篮,向Ba(OH)2溶液中加入1~2滴酸碱指示剂。用0.01 mol/L草酸(H2C2O4)溶液进行滴定
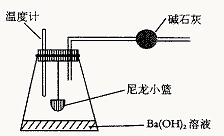
据以上实验回答下列问题
(1)小麦种子呼吸作用时,产生CO2的场所是
a. 细胞质基质
b. 核糖体
c. 高尔基体
d. 线粒体
e. 内质网
A.a、e B. b、d C. d D. a、d
(2)实验过程中,种子呼吸作用的产物主要是_______________,温度计上的读数将会_____________,原因是_______________________________。
(3)碱石灰的作用是___________________。每10 min左右,轻轻摇动锥形瓶,其目的是______________________________________________。
(4)若滴定时,消耗V mL的0.01 mol/L H2C2O4溶液,则该条件下小麦的呼吸效率为_______________________________。
26.(14分)一种物质的“放射性”强弱可用放射性活度表示,任何放射性元素在1 s内发射3.74×1010 个α粒子或β粒子(相当1 g![]() 在1 s内发射α粒子的数目),其放射性活度为1居里(Ci)。利用放射性同位素标记原子的应用范围非常广泛。例如,化学反应的微观过程的研究、医学检验、辐射育种等等。
在1 s内发射α粒子的数目),其放射性活度为1居里(Ci)。利用放射性同位素标记原子的应用范围非常广泛。例如,化学反应的微观过程的研究、医学检验、辐射育种等等。
试回答以下问题:
(1)现有n mol镭(![]() ),它的放射性活度为4.25 Ci,则n的值为_________。
),它的放射性活度为4.25 Ci,则n的值为_________。
(2)已知:![]() →
→![]() ,则另一个
,则另一个![]() 含有_________个中子。
含有_________个中子。
(3)如何证明溶解于苯的HCl分子与苯分子中H原子之间不断地发生着氢交换。
______________________________________________________
______________________________________________________
(4)在植物的光合作用中,若用H![]() O和CO2为原料,此过程中所生成的氧气相对分子质量为_________。
O和CO2为原料,此过程中所生成的氧气相对分子质量为_________。
27.(12分)用下图所示装置制取三氯化磷。在曲颈瓶d中放入足量白磷,将氯气迅速而又不间断地通入曲颈瓶中,氯气与白磷就会发生反应,产生火焰。
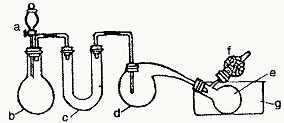
(1)为迅速得到持续的氯气,若b中装MnO2,则a中应装_______________,对b还须_______________。
(2)生成的PCl3在e中收集,为使PCl3蒸气冷却,g中加入____________________。
(3)PCl3遇水蒸气强烈反应,所以d、e仪器及装入其中的物质不能含有水分。为此,C中应装入_______________(填化学式)。
| 熔点 | 沸点 | |
| PCl3 PCl5 | -112℃ 148℃ | 76℃ 2200℃分解 |
(4)从冷水中取出白磷,应用滤纸吸干表面水分,浸入无水酒精中片刻,再浸入乙醚中片刻,即可除去水分,已知水与酒精互溶,酒精与乙醚互溶,用上述方法可除去水的理由是_______________________________。
(5)装置末尾导出的气体,应用_______________溶液处理。
28.(8分)在长期载人太空飞行的宇航器中,每个宇航员平均每天需要消耗0.9 kg氧气,呼出0.1 kg二氧化碳。为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的科学探索。
方法一:有的科学家提出“金属过氧化物处理系统”,即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。有关反应的化学方程式是①_____________②_____________;将处理后的气体充入座舱时,应注意采取的一项措施是_______________________________。
方法二:有的科学家根据电解原理设计了飞船内空气更新实验系统,该系统结构示意图如下:
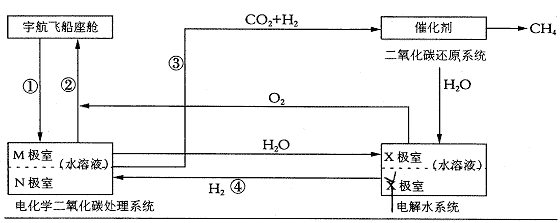 (1)管道①把飞船座舱中含较多二氧化碳的潮湿空气通入“电化学二氧化碳处理系统”的N极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为___________________,其电解产物吸收二氧化碳的离子方程式为____________________。在N极吸收二氧化碳后形成的离子会通过隔膜进入M极室,通过M极的电极反应可使二氧化碳从电解液中释放出来,并保持系统内的pH不变;该电极反应式为____________________________,二氧化碳逸出的离子方程式为____________________________。
(1)管道①把飞船座舱中含较多二氧化碳的潮湿空气通入“电化学二氧化碳处理系统”的N极室,通过该电极反应可以使二氧化碳不断被吸收;该电极反应式为___________________,其电解产物吸收二氧化碳的离子方程式为____________________。在N极吸收二氧化碳后形成的离子会通过隔膜进入M极室,通过M极的电极反应可使二氧化碳从电解液中释放出来,并保持系统内的pH不变;该电极反应式为____________________________,二氧化碳逸出的离子方程式为____________________________。
(2)管道②是将处理后的空气混入“电解水系统”产生的新鲜氧气,然后通入飞船座舱内供宇航员呼吸用。在“电解水系统”中,Y为_____________极(填“阴”或“阳”),X极的电极反应式为__________________________。
(3)逸出的二氧化碳没有排出飞船外,而是通过管道③进入“二氧化碳还原系统”。在该系统内,二氧化碳跟氢气在一定条件下反应,其产物有甲烷等气体,请评价这样处理的重要意义_________________________________________________________。
29.(16分)容积为0.672 L的密闭容器中,有一定质量的氧气和甲烷的混合气(其中含有甲烷气体0.48 g),混合气的温度为546 k,压强为4.04×105 Pa, 容器壁上还有一点火装置。已知1 mol CH4完全燃烧生成液态水时放出热量890 kJ,1 mol无烟煤完全燃烧放出热量403.2 kJ。
问:(1)混合气中甲烷气体的压强为_________。
(2)混合气中所含氧气的质量为_________ g。
(3)完全燃烧无烟煤和甲烷放出相同热量时,所释放的CO2的百分比,哪个大?_________。根据上述比较,可得出什么结论?_________________________。
30.(20分)“9.11事件”发生后不久,在美国又出现了炭疽热病。炭疽热病是一种由炭疽热杆菌引发的急性传染病,致死率高达25%至60%。治 疗炭疽热病的常用抗生素为环丙沙星,其结构简式为:

回答下列问题:
(1)从细胞结构来看,炭疽热杆菌属于_____________生物;
(2)环丙沙星的分子式为_____________,该分子结构中含有的含氧官能团,名称是____________基和_____________基(请填写汉字)。
(3)在通常条件下1 mol该物质最多能与_____________mol H2加成,能与_____________mol Br2加成;
(4)试写出该物质与CH3CH218OH在催化剂作用下发生反应的化学方程式:
_______________________________________。
(5)写出它属于酯类的一种同分异构体的结构简式:
31.(20分)给你下列器材:待测直流电源1个(电动势未知,内电阻约为几欧);电阻箱1个;开关1个;电流表和电压表各1个,两个电表的表盘均有刻度但无刻度值,且两电表量程均符合要求;另有导线若干条。
(1)请从上述器材中选出你认为必需的器材,设计一个电路测定待测电源的内电阻,画出电路图。
(2)简要写出完成接线后的实验操作方案。
(3)推导出用你所测出的物理量计算电源内电阻的表达式。
(4)根据你设计的电路,为了提高电源内电阻的测量精确度,你对电流表、电压表的内电阻有何要求?对从电阻箱中选用的测量电阻值有何要求?(只要求写出结论,不要求写出分析过程)
32.(13分)太阳的能量来自下面的反应:四个质子(氢核)聚变成一个α粒子,同时发射两个正电子和两个没有静止质量的中微子。已知氢气燃烧 与氧气化合成水,每形成一个水分子释放的能量为6.2 eV,若想产生相当于太阳上1 kg的氢核聚变成α粒子所释放的能量,需燃烧多少千克氢气?
α粒子质量mα=4.0026 u,质子质量mP=1.00738 u,电子质量me=5.48×10-4 u(u为原子质量单位)。
33.(11分)如下图所示,一段闭合螺线管套放在光滑水平玻璃棒上,一个光滑水平玻璃板中心沿螺线管的轴线穿过,板足够长,质量为M的条形磁铁放在板上螺线管管口的一端。现给条形磁铁一个冲量,使条形磁铁以速率v0穿过螺线管,条形磁铁穿出螺线管时的速率为![]() v0,螺线管的质量为
v0,螺线管的质量为![]() M。
M。
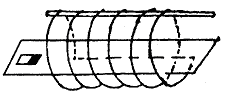
(1)试分析、论述相互作用过程中磁铁和螺线管的受力情况与运动情况。
(2)求条形磁铁穿过螺线管的过程中螺线管产生的热量。
34.(9分)某同学在跳绳比赛中,1 min跳120次,若每次起跳中2/5时间腾空,该同学体重50 kg。
(1)计算他起跳时最大高度为多少?
(2)他在跳绳过程中重力做功的平均功率为多少?(g取10 m/s2)
(3)运动过程中测得他的心跳为140次/min,血压平均为3×104 Pa,已知心跳一次约输送10-4 m3的血液,而平时心脏正常工作的平均功率约为1.5 W,分析他跳绳时心脏工作的平均功率提高了多少倍?
(4)人在剧烈运动时,处于暂时相对缺氧状态的骨骼肌,可通过无氧呼吸来获得少量能量,剧烈运动时,体内糖分解的产物是
A.CO2、水和乳酸 B.CO2和酒精
C.CO2和水 D.乳酸