试卷类型:A
2003年MAM高考理综仿真试题(八)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷第1至5页,第Ⅱ卷第6至12页。满分为300分,考试时间为150分钟。
第Ⅰ卷(选择题 共132分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
一、选择题(本题共22小题,每小题6分,共132分,每小题的四个选项中只有一项符合题意)
1.12月1日是“世界艾滋病日”,艾滋病已成为人类需要攻克的主要难题之一,艾滋病的主要传播媒介是
A.蚊和蝇
B.握手和拥抱
C.卧具和餐具
D.血液和精液
2.如下图是植物细胞部分膜结构示意图,按①②③④顺序排列,它们分别属于

A.细胞膜、高尔基体膜、线粒体膜、核膜
B.细胞膜、叶绿体膜、线粒体膜、内质网膜
C.线粒体膜、核膜、内质网膜、高尔基体膜
D.叶绿体膜、细胞膜、线粒体膜、核膜
3.家庭性高胆固醇血症是一种遗传病,杂合体约活到50岁就常患心肌梗塞,纯合体常于30岁左右死于心肌梗塞,不能生育。一对患有家族性高胆固醇血症的夫妻,已生育一个完全正常的孩子,如果再生一个男孩,那么这个男孩能活到50岁的概率是
A.1/3 B.2/3 C.1/2 D.3/4
4.在农田生态系统中,其中的两条食物链是
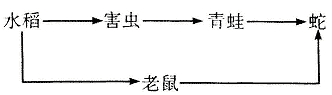
如果大量捕食青蛙,造成的严重后果是
A.蛇的数量大大增加
B.虫害严重,水稻减产
C.老鼠大量增加危害粮食
D.青蛙减少,维持了生态系统平衡
5.下列关于代谢的叙述不正确的一项是
A.白鼠细胞中ADP含量上升表明葡萄糖氧化作用加强
B.白鼠细胞中ADP含量上升表明磷酸肌酸减少
C.具有运氧功能的红细胞,自身靠无氧呼吸作用提供能量
D.糖的无氧呼吸过程,不论是酵母菌,还是动物、植物都基本相同的事实,说明生物界
具有统一性
6.下列现象与环境污染无关的是
A.臭氧层空洞 B.酸雨
C.光化学烟雾 D.潮汐
7.超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料,经研磨烧结可合成一种高温超导物质YBa2Cu3Ox,现欲合成0.5 mol此高温超导物,需取
Y2O3、BaCO3和CuO的物质的量分别为
A.0.5、 0.5、 0.5 B.0.25、 1.0、 1.5
C.0.5、 1.0、 1.5 D.1.0、 0.25、 0.17
8.在高科技工业中,有的高分子材料能用在能量转换上,如传感膜能够把化学能转化为电能,热电膜能够把热能转化成电能等,这种高分子材料是
A.高分子膜
B.医用高分子材料
C.生物高分子材料
D.液晶高分子材料
9.气缸中空气进量过少或过多时,产生的主要有害气体依次是
A.气态烃和NO、NO2等
B.CO和NO、NO2等
C.CO和CO2
D.气态烃和CO2
10.随着人们生活质量的不断提高,废电池必须进行集中处理的问题被提到议事日程,其首要原因是
A.利用电池外壳的金属材料
B.防止电池中汞、镉和铅等重金属离子对土壤和水源的污染
C.不使电池中渗泄的电解液腐蚀其他物品
D.回收其中石墨电极
11.由乙醇制取环乙二酸乙二酯![]() 时,最简便的流程需要下列哪些反应,其顺序正确的是
时,最简便的流程需要下列哪些反应,其顺序正确的是
①取代 ②加成 ③氧化 ④还原 ⑤消去 ⑥酯化 ⑦中和
A.①②③⑤⑦ B.⑤②①③⑥
C.⑤②①④⑦ D.①②⑤③⑥
12.某电解质溶液的pH=a,向其中插入两石墨电极,通电一段时间后,测知溶液的pH=b,且b<a,且阴、阳两极析出产物的物质的量之比为2∶1,该电解质溶液是
A.硫酸钾溶液 B.氯化钠溶液
C.硫酸溶液 D.硝酸银溶液
13.在一个体积可变的密闭容器中,盛有等物质的量的SO3(g)、SO2、O2等混合气体,在一定温度和压强下,反应达到平衡时,容器中混合气体的密度比反应前减少了![]() (温度、压强不变),则反应达到平衡时,混合气体中SO2占总体积的
(温度、压强不变),则反应达到平衡时,混合气体中SO2占总体积的
A.1/3 B.1/6 C.2/13 D.6/13
14.人体正常的血红蛋白中含有亚铁离子。若误食亚硝酸盐,则会导致血红蛋白中亚铁离子转化为铁离子而中毒。服用维生素C可解除亚硝酸盐中毒。下列说法正确的是
A.亚硝酸盐是还原剂
B.维生素C是还原剂
C.维生素C能氧化Fe2+
D.上述过程中,亚硝酸盐被血红蛋白或维生素C氧化
15.一个电子在静电场中运动,且只受电场力作用,则在一段时间内
A.电子的电势能一定减小
B.电子一定从高电势向低电势运动
C.电子速率一定增大
D.电子一定做变速运动
16.杨氏双缝干涉实验中,下列说法中正确的是(n为自然数,λ为光波波长)
①在距双缝的路程相等的点形成暗条纹
②在距双缝的路程差为nλ的点形成亮条纹
③在距双缝的路程差为![]() 的点形成亮条纹
的点形成亮条纹
④在距双缝的路程差为(n+![]() )λ的点形成亮条纹
)λ的点形成亮条纹
A.①② B.②③ C.③④ D.②④
17.下列说法正确的是
①机械能不通过做功可以转化为内能
②不通过做功,也可以改变物体的内能
③物体的分子热运动的动能的总和就是内能
④对物体做功,其内能也可能改变
A.①③ B.②④ C.②③④ D.③④
18.正在运转的机器,当其飞轮转得很快时,机器的振动并不强烈。切断电源,飞轮转动逐渐慢下来,到某一时刻t,机器反而会发生强烈的振动。此后飞轮转速继续变慢,机器的振动也随之减弱,这种现象说明
A.在时刻t,飞轮的惯性最大
B.在时刻t,飞轮的转动频率最大
C.在时刻t,飞轮的转动频率与机身的固有频率相等,发生共振
D.纯属偶然现象,并无规律
19.如图所示 ,S1、S2为水波槽中的两个波源,它们分别激起两列水波,图中实线表示波峰,虚线表示波谷,已知两列波的波长λ1、λ2,该时刻在P点为两列波的波峰与波峰相遇,则以下叙述正确的是
,S1、S2为水波槽中的两个波源,它们分别激起两列水波,图中实线表示波峰,虚线表示波谷,已知两列波的波长λ1、λ2,该时刻在P点为两列波的波峰与波峰相遇,则以下叙述正确的是
A.P点有时在波峰,有时在波谷,振动始终相互加强
B.P点始终在波峰
C.因为λ1>λ2,所以P点的振动不遵守波的叠加原理
D.P点的振动遵守波的叠加原理,但并不始终相互加强
20.1998年8月,中国天文学家观测到,某行星外围有一模糊不清的环,为了判断该环是连续物还是卫星群,科学家们又测出了环上各层的线速度V的大小与该层到行星中心的距离R,从而作出正确判断,下列各项判断正确的是
①若V与R成正比,则环是连续物
②若V与R成反比,则环是连续物
③若V2与R成正比,则环是卫星群
④若V2与R成反比,则环是卫星群
A.①④ B.②③ C.②④ D.①③
21.下列说法正确的是
A.380 V交流电的有效值为380 V
B.交流电压表和电流表测量的是平均值
C.正弦式电流的有效值等于平均值
D.耐压280 V的电容器不能接在220 V的交流电中
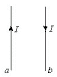 22.如图所示,两根平行放置的长直导线a和b载有大小相同、方向相反的电流,a受到的磁场力大小为F1,当加入一与导线所在平面垂直的匀强磁场后,a受到的磁场力大小变为F2,则此时b受到的磁场力大小变为
22.如图所示,两根平行放置的长直导线a和b载有大小相同、方向相反的电流,a受到的磁场力大小为F1,当加入一与导线所在平面垂直的匀强磁场后,a受到的磁场力大小变为F2,则此时b受到的磁场力大小变为
A.F2 B.F1-F2
C.F1+F2 D.2F1-F2
第Ⅱ卷(非选择题 共168分)
注意事项:
1.第Ⅱ卷共7页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
23.(18分)用狗作实验材料设计一个实验,证明动物生长激素的分泌器官及其生理作用:
(1)实验材料选用___________的狗;
(2)实验处理:实验组Ⅰ___________;
实验组Ⅱ___________;
对照组___________。
(3)观察现象:实验组Ⅰ___________;
实验组Ⅱ___________。
 (4)结论___________。
(4)结论___________。
24.(12分)右图表示某动物的一个体细胞,在完全显性条件下,试回答下列问题:(1)具有这种基因型的个体叫___________。
A.单倍体 B.多倍体
C.纯合体 D.杂合体
(2)该细胞进行有丝分裂时,其一个细胞周期包括___________和___________两个阶段。
(3)该细胞有丝分裂后期染色单体数为___________,有___________个脱氧核苷酸长链,形成的子细胞的基因型是___________。
(4)若该图表示一个卵原细胞,在减数分裂时,A、a遵循___________规律遗传,经减数分裂产生了一个含有A基因的卵细胞,另外三个极体的基因组成为___________、___________、___________。
(5)若该细胞与隐性类型测交,产生的后代有___________种表现型,其比例为___________。
25.(12分)取一株油菜幼苗,注入(NH4)2SO4溶液(pH为6.42),在室温下4小时后取出植株,测定溶液pH为6.01,问:
(1)(NH4)2SO4溶液pH下降的原因是:
___________
(2)(NH4)2SO4溶液pH=6.42,为何pH小于7?
___________
(3)用箭头表示溶液中一个NH4+被吸收到叶肉细胞的过程:
___________
26.(16分)吸烟是危害人体健康的恶习。现代医学科学证明,烟草燃烧时会释放出1000多种化合物,绝大多数对人体有害,且有不少于44种的致癌物质。如烟焦油、烟碱(如尼古丁)、一氧化碳、醛类(如苯甲醛)、胺类(如联苯胺)等。根据世界卫生组织提供的资料,全世界每年约有1000万人死于与吸烟有关的疾病。
青少年正处于生长发育时期,呼吸道粘膜容易受损,吸烟的危害性更大。据调查,小于15岁开始吸烟的人,比不吸烟的人肺癌发病率高17倍。所以,我国中学生守则规定学生不准吸烟。
回答下列问题:
(1)①1988年,世界卫生组织把每年的___________定为“世界无烟日”,以敦促各国政府、社区、组织和个人,采取适当行动来制止吸烟行为。
A.3月21日 B.3月22日 C.4月7日 D.5月31日 E.6月26日
②烟草中还含有U,Ra-226,Po-210,Pb-210等元素,它们会造成___________污染,这种污染物质致癌的原因是___________。
A.DNA中的碱基对的改变
B.DNA中的碱基对的增加
C.DNA中的碱基对的减少
D.染色体数目的改变
③吸烟不仅危害自己的健康,而且危害周围人的健康,是一种很不卫生的习惯。科学与测试证明,一个吸烟者只能吸入30%的烟雾,而70%的烟雾散布在周围的空气中。请问“被动吸烟”对人体健康的危害主要表现为___________疾病的多发。
A.皮肤 B.消化系统 C.呼吸道 D.神经系统
④90年代初,国际上提出了“预防污染”的根本手段。下列活动属于实施绿色化学活动的是___________
A.处理废弃物——烟灰、烟蒂
B.治理污染物——通风,排除烟雾
C.减少有毒物——使用过滤嘴、低焦油烟
D.杜绝污染物——禁烟、戒烟
香烟烟雾中有关有害成分的检验可按下图装置进行实验:
1.蒸馏水;2.蒸馏水+2滴新鲜鸡血;3.KMnO4酸性溶液;4.丙酮;5.蒸馏水+1 mL动物油。
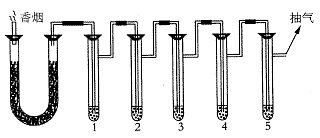
实验时先点燃香烟,并抽气。当燃完两三支烟后,观察并依次做部分性质实验。
(2)取1管中的液体3~5滴,做银镜实验,可观察到的实验现象是___________。证明烟气中含有___________类物质。写出有关离子反应式 。
(3)烟气过后,可以观察到2管中出现___________现象,证明烟雾中含有CO气体。
27.(10分)取1~5号五支试管,分别加入2.0 mL3.0%的过氧化氢溶液,实验如下:
| 编号 | 往试管中加入物质 | 实验结果 |
| 1 | 1mL唾液 | 无气泡 |
| 2 | 锈铁钉 | 少量气泡 |
| 3 | 两小块新鲜猪肝 | 大量气泡 |
| 4 | 两小块新鲜猪肝,0.5mL 1.0mol·L-1的盐酸 | 大量气泡 |
| 5 | 两小块新鲜猪肝,0.5mL 1.0mol·L-1的NaOH溶液 | 少量气泡 |
注:新鲜猪肝中含较多的过氧化氢酶。
试回答下列问题:
(1)3号试管中的两小块新鲜猪肝的作用是___________,此反应的化学方程式是______________________,当试管中的反应物完全反应后,转移的电子总数是___________个(设3%过氧化氢溶液的密度为1.0 g·cm-3)。
(2)___________号试管和___________号试管的实验结果比较,可说明酶的专一性。___________号试管和___________号试管的实验结果比较,可说明酶的高效性。
(3)3和4、5试管实验结果比较,可说明______________________。
28.(12分)X、Y、A、B、C、D是中学化学教材中常见的物质,且有如下转化关系。气体C的式量比气体X的式量大2,产物中水已忽略。
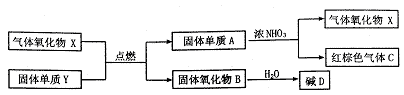
回答下列问题:
(1)X分子的电子式是___________。
(2)Y原子的结构示意图是___________。
(3)在上述转化过程中作氧化剂的物质有(按氧化性由强到弱的顺序排列)___________。
29.(14分)随着现代工业的发展,能源问题已经越来越引起人们的重视,科学家预言,未来最理想的燃料是绿色植物,即将植物的秸杆(主要成分是纤维素)用适当的催化剂作用水解成葡萄糖,再将葡萄糖转化为乙醇,用作燃料。
(1)写出绿色植物的秸秆转化为乙醇的化学方程式①___________;②______________________。
(2)乙醇除用作燃料外,还可以用它化合成其他有机物,下列主要是以乙醇为起始原料的转化关系图,请在表中填上相应的物质的结构简式:
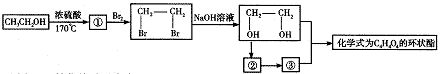
(3)写出上面转化关系图中由CH2OHCH2OH→C4H4O4的化学方程式(用有机物结构简式来表示)___________。
30.(20分)关于卤族元素的碘及碘化氢
(1)碘化氢不稳定,怎样用简单的方法证明碘化氢的分解产物碘的存在?
___________
(2)碘化氢与硝酸银溶液反应的产物之一具有感光性,试写出其见光分解的化学反应方程式:
___________
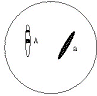
(3)如果将结构简单的碘化氢(HI)分子想象为键的两端有两个离子,如同将两个不同的质量的物体在弹簧两端振动的情况一样(如图所示)。
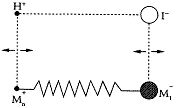
①假若在此模型中能够忽略碘离子的运动,试写出联系a、M(H+)、k、x之间的方程式(a为氢离子运动的加速度,M(H+)为氢离子的质量,k为键的劲度系数,x为氢离子运动的位移)。
②当电磁波通过碘化氢气体时,发现一平均波长为4.6×10-6 m吸收带,试计算吸收辐射的平均频率。
③试解释为何略去碘离子的运动是合理的,并指出应用此模型还需要假设H+做何运动?
31.(19分)为了测量两张纸之间的动摩擦因数,某同学设计了一个实验:如下图所示,在木块A和木板B上贴上待测的纸,B板水平固定,砂桶通过细线与A相连,调节砂桶中砂的多少,使A匀速向左运动,测出砂桶和砂的总质量m以及贴纸的木块A的质量M,则μ=m/M。
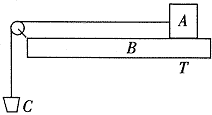
(1)该同学为什么要把纸贴在木板上而不直接测量两张纸间的滑动摩擦力?
(2)在实际操作中,发现要保证A做匀速运动比较困难,你能对这个试验作一改进来解决这一困难吗?(可根据自己设计的实验方案添加实验器材)
32.(24分)如图所示,厚度为h,宽度为d的导体板放在垂直于它的磁感应强度为B的匀磁场中。当电流通过导体板时,在导体板的上侧面A和下侧面A′ 之间会产生电势差,这种现象称为霍尔效应。实验表明,当磁场不太强时,电势差U、电流I和B的关系为![]() 。式中的比例系数K称为霍尔系数。
。式中的比例系数K称为霍尔系数。
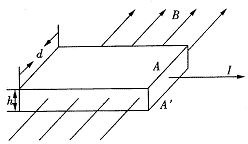
霍尔效应可解释如下:外部磁场的洛伦兹力使运动的电子聚集在导体板的一侧,在导体板的另一侧会出现多余的正电荷,从而形成横向电场。横向电场对电子施加与洛伦兹力方向相反的静电力。当静电力与洛伦兹力达到平衡时,导体板上下两侧之间就会形成稳定的电势差。
设电流I是由电子的定向流动形成的,电子的平均定向速度为v,电量为e,回答下列问题:
(1)达到稳定状态时,导体板上侧面A的电势___________下侧面A′ 的电势(填“高于”“低于”或“等于”);
(2)电子所受的洛伦兹力的大小为___________;
(3)当导体板上下两侧之间的电势差为U时,电子所受静电力的大小为___________;
(4)由静电力和洛伦兹力平衡的条件,证明霍尔系数为![]() ,其中n代表导体板单位体积中电子的个数。
,其中n代表导体板单位体积中电子的个数。
33.(11分)(1)1791年,米被定义为:在经过巴黎的子午线上,取从赤道到北极长度的一千万分之一。请由此估算地球的半径R。(答案保留二位有效数字)
(2)太阳与地球的距离为1.5×1011 m,太阳光以平行光束入射到地面。地球表面2/3的面积被水面所覆盖,太阳在一年中辐射到地球表面水面部分的总能量W约为1.87×1024 J。设水面对太阳辐射的平均反射率为7%,而且将吸收到的35%能量重新辐射出去。太阳辐射可将水面的水蒸发(设在常温、常压下蒸发1 kg水需要2.2×106 J的能量),尔后凝结成雨滴降落到地面。
a.估算整个地球表面的年平均降雨量(以毫米表示,球面积为4πR2)。
b.太阳辐射到地球的能量中只有约50%到达地面,W只是其中的一部分,太阳辐射到地球的能量没能全部到达地面,这是为什么?请说明两个理由。