2003年MAM高考化学仿真试题(五)
MAM: M-March A-April M-May
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。第Ⅰ卷1至4页,第Ⅱ卷5至8页。共150分,考试时间120分钟。
第Ⅰ卷(选择题 共74分)
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、准考证号、考试科目、试卷类型(A、B)用铅笔涂写在答题卡上。
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦干净后,再选涂其他答案标号。不能答在试卷上。
3.考试结束后,考生将本试卷和答题卡一并交回。
一、选择题(本题包括8小题,每小题3分,共24分;每小题只有一个选项符合题意)
1.据报道,科学家在宇宙中发现了H3分子,则H3和H2属于
A.同系物 B.氢的同位素 C.氢的同素异形体 D.同分异构体
2.在下列比较中,正确的是
A.热稳定性:HI>HBr>HCl>HF
B.单质密度:Li>Na>K>Rb
C.微粒半径:S2->Cl->K+>Ca2+
![]()
3.下列事实不能用勒夏特列原理解释的是
A.往H2S水溶液中加碱有利于S2-的增加
B.加入催化剂有利于氨氧化的反应
C.500℃左右比室温更有利于合成氨的反应
D.高温有利于合成氨的反应
4.钢铁发生电化腐蚀时,负极发生的反应是
A.2H++2e-====H2 B.2H2O+4e-+O2====4OH-
C.Fe-2e-====Fe2+ D.4OH―2e-====2H2O+O2
5.从结构上分析推测![]() ,最不可能具有的性质是
,最不可能具有的性质是
A.能使溴水褪色 B.能加聚成高聚物
C.能发生水解反应 D.能被银氨溶液氧化产生银镜
6.在室温下将pH=3的强酸溶液和pH=12的强碱溶液混合,当混合溶液的pH=11时,强酸与强碱溶液的体积之比是
A.9∶2 B.9∶1 C.1∶10 D.2∶5
7.若与有机物中一个碳原子以单键形式连有四个不同的原子或原子团时,该原子被称为
手性碳原子。具有手性碳原子的物质常具有光学活性。有机物A(
![]() )
)
具有光学活性。但当A发生了下列一系列变化后,可能会失去光学活性。
①银镜反应;②水解反应;③与灼热的CuO反应;④与乙酸发生酯化反应;⑤与氢溴酸反应;⑥与浓硫酸共热发生消去反应;
你认为能使A失去光学活性的一组是
A.②③④⑥ B.①②③④ C.②③④⑤ D.③④⑤⑥
8.下列溶液中,在空气里既不易被氧化,也不易分解,且可用无色玻璃试剂瓶存放的是
A.石炭酸 B.氢硫酸 C.硝酸银溶液 D.醋酸
二、选择题(本题包括10小题,每小题5分,共50分;每小题有一个或两个选项符合题意)
9.在0.1 mol·L-1NaHCO3溶液中有关粒子浓度关系正确的是
A.c(Na+)>c(HCO![]() )>c(CO
)>c(CO![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(OH-)
)+c(OH-)
C.c(Na+)+c(H+)=c(HCO![]() )+2c(CO
)+2c(CO![]() )+c(OH-)
)+c(OH-)
D.c(Na+)=c(HCO![]() )+c(CO
)+c(CO![]() )+c(H2CO3)
)+c(H2CO3)
10.向某溶液中加入铝粉,反应生成氢气,则原溶液中肯定不存在的离子组是
A.NH![]() 、Cl-、Na+、Ba2+ B.SO
、Cl-、Na+、Ba2+ B.SO![]() 、Cl-、CO
、Cl-、CO![]() 、Na+
、Na+
C.Al3+、Mg2+、SO![]() 、Cl- D.Cl-、NO
、Cl- D.Cl-、NO![]() 、Mg2+、Na+
、Mg2+、Na+
11.核内中子数为N的R2+,质量数为A,则m g它的氧化物中所含质子的物质的量为
A.![]() (8+A-N) mol B.
(8+A-N) mol B.![]() (10+A-N) mol
(10+A-N) mol
C.(A-N-2)
mol D.![]() (6+A-N) mol
(6+A-N) mol
12.下列离子方程式正确的是
A.饱和碳酸钠溶液中加入少量稀盐酸
CO![]() +2H+====CO2↑+H2O
+2H+====CO2↑+H2O
B.澄清石灰水与醋酸反应
OH-+CH3COOH====CH3COO-+H2O
C.铝粉溶于NaOH溶液中
2Al+2OH-+2H2O====2AlO![]() +3H2↑
+3H2↑
D.NH4HCO3溶液中加入过量NaOH溶液
NH![]() +OH-====NH3↑+H2O
+OH-====NH3↑+H2O
13.在温度、容器体积不变的条件下,起始时c(x2)=0.1 mol·L-1,c(y2)=0.3 mol·L-1,c(z)=0.2 mol·L-1,发生可逆反应,x2+3y2![]() 2z,达到平衡时,各物质的浓度可能正确的是
2z,达到平衡时,各物质的浓度可能正确的是
A.c(x2)=0.15 mol·L-1,c(y2)=0.45 mol·L-1
B.c(x2)=0.2 mol·L-1,c(y2)=0.6 mol·L-1
C.c(y2)=0.24 mol·L-1,c(z2)=0.24 mol·L-1
D.c(x2)=0.15 mol·L-1,c(z2)=0.15 mol·L-1
14.在一定温度下,向一定量的Na2CO3饱和溶液中加入1.06 g Na2CO3固体,搅拌后静置,最终所得晶体的质量(设原溶液足量)
A.等于1.06 g B.大于1.06 g而小于2.86 g
C.等于2.86 g D.大于2.86 g
15.在“绿色化学”工艺中,理想状态是反应物中原子全部转化为欲制得的产物,即原子利用率为100%。在用CH3C≡CH合成CH2==C(CH3)COOCH3的过程中,欲使原子利用率达到最高,还需要其他的反应物有
A.CO和CH3OH B.CO2和H2O
C.H2和CO2 D.CH3OH和H2
16.某混合溶液由两种或三种物质溶于水制成,且在溶液中,c(K+)=c(Cl-)=12c(Na+)=c(SO![]() )。则溶质可能是
)。则溶质可能是
A.KCl、Na2SO4 B.KCl、Na2SO4、NaCl
C.NaCl、Na2SO4、K2SO4 D.KCl、K2SO4、Na2SO4
17.某溶液中有NH![]() 、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
、Mg2+、Fe2+和Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A.NH![]() B.Mg2+ C.Fe2+ D.Al3+
B.Mg2+ C.Fe2+ D.Al3+
18.一定温度下,将a mol PCl5通入一个容积不变的反应器中,达到如下平衡:
PCl5(g)![]() PCl3(g)+Cl2(g),测得平衡混合气体压强为p1,此时再向反应器中通入a mol PCl5,在不变的温度下再度达到平衡,测得压强为p2,下列判断正确的是:
PCl3(g)+Cl2(g),测得平衡混合气体压强为p1,此时再向反应器中通入a mol PCl5,在不变的温度下再度达到平衡,测得压强为p2,下列判断正确的是:
A.2p1>p2 B.PCl5的分解率增大
C.2p1<p2 D.PCl3%(体积含量)减少
第Ⅱ卷(非选择题 共76分)
注意事项:
1.第Ⅱ卷共4页,用钢笔或圆珠笔直接答在试题卷中。(除题目有特殊规定外)
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | 26 | 总 分 |
| 分 数 |
19.(10分)如下图,已知A是常见的纯净气体,甲中黑色粉末为氧化铜或炭粉或两者的混合物。
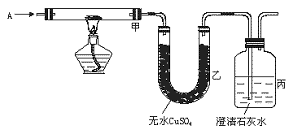
图5—1
(1)若A为CO2,在丙中可导出可燃性气体,则甲中反应的化学方程式为: 。
(2)若甲中黑色粉末为氧化铜,实验时甲处黑色变红色,乙处无变化,则A为 ,丙中的现象为 。
(3)若乙中白色粉末变蓝色,丙中出现白色浑浊物,则A为 ,黑色粉末为 。
20.(12分)实验室常用饱和NaNO2与NH4Cl溶液反应制取纯净氮气。反应式为:NaNO2+NH4Cl====NaCl+N2↑+2H2O+Q,实验装置如下图所示,试回答:

图5—2
(1)装置中A部的分液漏斗与蒸溜烧瓶之间连接的导管所起的作用是 。
A.防止NaNO2饱和溶液蒸发 B.保证实验装置不漏气 C.使NaNO2饱和溶液容易滴下
(2)B部分的作用是 。
A.冷凝 B.冷却氮气 C.缓冲氮气流
(3)加热前必须进行的操作步骤是 。加热片刻后,即应移去酒精灯以防反应物冲出,其原因是 。
(4)收集N2前,必须进行的步骤是(用文字说明) 。
收集N2最适宜的方法是(填编号) 。
a.用排气法收集在集气瓶中 b.用排水法收集在集气瓶中 c.直接收集在球胆或塑料袋中
四、(本题包括2小题,共22分)
|
|
|
③B+D====2KCl+MnO2+C↑
(1)写出A、B的化学式:A ;B
(2)第①步反应中,氧化产物是 ,被还原的元素是 。
(3)第③步反应的化学方程式为 。
22.(10分)在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如右图),容器中发生以下反应:N2+3H2![]() 2NH3+Q,若反应达平衡后,测得混合气体为7体积。据此回答问题:
2NH3+Q,若反应达平衡后,测得混合气体为7体积。据此回答问题:
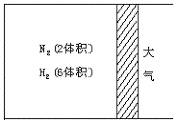
图5—3
(1)若保持上述反应温度不变,设a、b、c分别代表初始加入的N2、H2和NH3的体积,如果应达到平衡后混合气体中各物质的份数仍与上述平衡时完全相同,那么:①a=1,c=2,则b= ,在此情况下,反应起始向方向进行。(填“正”或“逆”)②若需规定反应起始时向逆方向进行,则c的取值范围是。
(2)在上述装置,若需控制平衡后的混合气体为6.5体积,则可采取的措施是 ,原因是 。
五、(本题包括2小题,共18分)
23.(8分)有一种名为菲那西汀的药物,其基本合成路线如下:
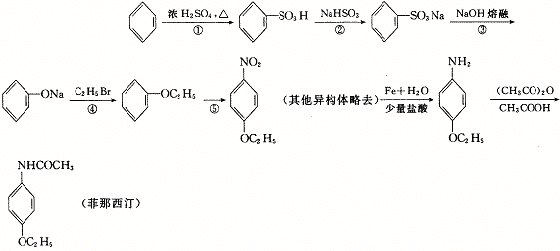 则:
则:
(1)反应②中生成的无机物化学式为 。
(2)反应③中生成的无机物化学式为 。
(3)反应⑤的化学方程式是 。
(4)菲那西汀水解的化学方程式为 。
24.(10分)如图所示,乙酸跟乙醇在浓硫酸存在并加热的条件下发生酯化反应(反应A),其逆反应是水解反应(反应B)。反应可能经历了生成中间体(Ⅰ)这一步。
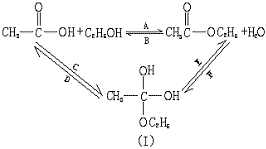
(1)如果将反应按加成、消去、取代反应分类,则A→F六个反应中(将字母代号填入下列横线上),属于取代反应的是 ;属于加成反应的是 ;属于消去反应的是 。
(2)中间体(Ⅰ)属于有机物的 类。
(3)如果将原料C2H5OH中的氧原子用18O标记,则生成物乙酸乙酯中是否有18O?如果将原料![]() 中羰基(
中羰基(![]() )或羟基中的氧原子用18O标记,则生成物H2O中氧原子是否含有18O?试简述你作此判断的理由。
)或羟基中的氧原子用18O标记,则生成物H2O中氧原子是否含有18O?试简述你作此判断的理由。
六、(本题包括2小题,共14分)
25.(3分)把过量铁粉投入到由CuCl2和FeCl3组成的混合液中,充分搅拌反应后,过滤、干燥不溶物,称得其质量与加入铁的质量相等。求原混合液中CuCl2和FeCl3的物质的量浓度之比是多少?
26.(11分)常温下,把CH4和O2组成的混合气体共a mol通入装有4.68 g Na2O2固体的密闭容器中,用电火花不断点燃,使之在高温下完全反应,恢复到常温时,容器内气压几乎为零。
(1)讨论剩余固体的成分与a的取值、CH4与O2的体积比值(n)三值的关系,填写下列表格。
| 剩余固体 a的取值 n= |
(2)当剩余固体全部加入足量盐酸中,产生560 mL气体(标准状况),剩余干燥的固体质量是多少?