高三理综物理部分第三次练习题
第Ⅰ卷 (选择题 共126分)
在下列各题的四个选项中。只有一个选项是最符合题目要求的。每小题6分。共126分。
以下数据可供解题时参考:
相对原子质量:H 1 Li 7 Be 9 C 12 O 16 Na 23 Mg 24 P 31 Cl 35.5 K 39 Ca 40
1.人体内血钙含量过高,会导致
A.肌肉抽搐 B.佝偻病
C.肌无力 D.骨质软化病
2.在光学显微镜下可分辨出植物细胞的细胞膜的时期是
A.有丝分裂间期 B.有丝分裂中期
C.质壁分离时 D.吸胀吸水时
3.运动神经末梢释放乙酰胆碱属于
A.自由扩散 B.主动运输
C.内吞作用 D.外排作用
4.组织培养过程中,愈伤组织能形成幼苗的过程属于
A.分化 B.脱分化
C.再分化 D.分裂
5.一个豆荚内含三粒种子,则此豆荚的形成需要的精子、胚珠、子房的数目分别为
A.6、3、1 B.3、1、1
C.6、1、1 D.3、3、3
6.将一只盛有一定量稀盐酸的圆底烧瓶放进一只盛有水的大烧杯中,圆底烧瓶处于漂浮状态,浸入水中的体积如图3-1所示。用细铜丝悬挂一小块石灰石,并小心地将石灰石连同细铜丝一起投入稀盐酸中,待静止后,烧瓶浸入水中的体积与原来相比
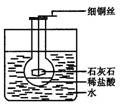
图3-1
A.增大 B.不变
C.减小 D.无法判断
7.海水中含有氯化镁,是镁的重要来源之一。从海水中提取镁,可按如下步骤进行:①把贝壳制成石灰乳;②在引入的海水中加入石灰乳,沉降、过滤、洗涤沉淀物;③将沉淀物与盐酸反应,结晶过滤、干燥产物;④将得到的产物熔融后电解。关于提取镁,下列说法不正确的是
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取MgCl2
C.第④步电解时阳极会产生氯气
![]() D.以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应
D.以上提取镁的过程中涉及到的反应有分解反应、化合反应和置换反应
8.草药莪术根茎中含有一种色素,它的结构简式为CH2—(CO—CH==CH OH)2用它制成的试纸可以检验溶液的酸碱性。能够跟1 mol该化合物起反应的Br2(水溶液)或H2的最大用量分别是
A.3 mol、3 mol B.3 mol、5 mol
C.6 mol、6 mol D.6 mol、10 mol
9.乙炔在一定条件下与水的加成反应,其过程如下:
CH≡CH+H—OH→[H2C==CH—OH]→CH3CHO?
式中H2C==CH—OH不稳定,在常温下为液体,很容易转化成稳定的CH3CHO。然而,2002年的美国《科学》杂志报道:外太空的某一个星球的大气层含有大量的H2C==CH—OH。请从化学平衡的角度预测一下该星球的温度是
A.较低温度 B.较高温度
C.无法判断温度的高低 D.上述说法都不正确
10.下列的分离或提纯方法中不正确的是
A.用蒸馏法分离乙醚和乙酸乙酯
B.除去蛋清液中的食盐可用渗析法
C.氯化镁酸性溶液中有少量Fe3+,可加MgO除去
D.用纯碱溶液除去CO2中混入的少量HCl
11.最近,科学家用一种称为“超酸”的化合物H[(CB11H6Cl6)]和C60反应,使C60获得一个质子,得到一种新型离子化合物[HC60]+[CB11H6Cl6]—。该反应看起来很陌生,其实在反应类型上可以跟中学化学里某个熟悉的化学反应相比拟。该化学反应是
A.Zn+2HCl===ZnCl2+H2↑
B.H2O+CH3COOH![]() H3O++CH3COO—
H3O++CH3COO—
C.NH3+HCl===NH4Cl
D.CO2+2NH3===CO(NH2)2+H2O
12.试管中装有足量的煤油和水的混合物,静置后投入一小块碱金属。可观察到金属在煤油和水的界面附近上下往复运动。下列说法不正确的是
A.此碱金属可能是钾或钠
B.反应一段时间煤油会燃烧
C.碱金属上下运动是由于碱金属与水反应产生了氢气
D.若是金属铷则上下运动的幅度比钠大
13.如图3-2,装置中各盛有0.1 mol·L-1的NaCl溶液,放置一定时间后,装置中四块相同的锌片腐蚀速率由快到慢的是
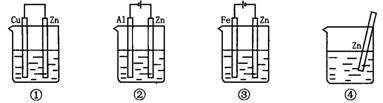
图3-2
A.③①④② B.①②④③
C.①②③④ D.②①④③
14.以下说法正确的是
A.太阳辐射的能量主要来自太阳内部的裂变反应
B.卢瑟福的α粒子散射实验可以估算原子核的大小
C.玻尔原子理论是依据α粒子散射实验分析得出的
D.氢原子核外电子从半径较小的轨道跃迁到半径较大的轨道时,电子的动能减小,电势能增大,总能量不变
15.一人站在竖直放置的平面镜前某处时,从平面镜中看到自己的全身像和周围一些景物的像。若此人远离平面镜后退若干步,他从平面镜中
A.仍看到自己的全身像,景物范围扩大
B.仍看到自己的全身像,景物范围缩小
C.看不到自己的全身像,景物范围扩大
D.看不到自己的全身像,景物范围缩小
16.下面的叙述不正确的是
A.分子之间既有引力作用,又有斥力作用
B.当分子之间距离增大时,分子间的引力和斥力都减小
C.气体分子平均动能越大,其压强一定越大
D.温度相同时,分子质量不同的两种气体,其分子平均动能一定相同
17.我国于1984年4月8日成功地发射了第一颗试验通信卫星,这种卫星相对地面静止不动,犹如静止在空中一样,所以又叫同步卫星。关于同步卫星,下列说法正确的是
①同步卫星的角速度和地球自转的角速度相同,高度和速率可根据需要调整
②同步卫星和地球同步,其高度和运行速度必须是特定的
③同步卫星可处于地球不同纬度的上空
④同步卫星只可处于地球赤道的上空
A.②④ B.①③
C.①② D.③④
18.关于电磁感应,下列说法正确的是
A.穿过线圈的磁通量变化越大,感应电动势越大
B.线圈接通电源时刻,其自感电动势的大小不会超过电源的路端电压
C.穿过线圈的磁通量减小时,感应电动势可能越来越大
D.导体平动切割磁感线的速度越大,导体上的感应电动势越大
19.如图3-3所示,三个定值电阻接在一电动势为E=240 sin π·t(V)的交流电源上,三个电阻消耗的功率相等,通过R1电流的最大值为1 A。则
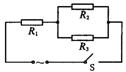
图3-3
A.R1=80 Ω B.R1=160 Ω
C.电路总功率为240 W D.t=0时,电路总电流不为零
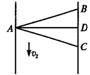 20.船在静水中的速度为v1,水流的速度为v2。已知船能分别沿AB、AC方向过河,且过河所用的时间分别为tB、tC。设河宽一定,且AB、AC与垂直对岸的AD夹角相同,如图3-4所示。以下说法正确的是
20.船在静水中的速度为v1,水流的速度为v2。已知船能分别沿AB、AC方向过河,且过河所用的时间分别为tB、tC。设河宽一定,且AB、AC与垂直对岸的AD夹角相同,如图3-4所示。以下说法正确的是
图3-4
A.v1一定小于v2 B.v1不一定大于v2
C.tB一定大于tC D.tB不一定大于tC
21.如图3-5所示,水平放置的光滑平行金属导轨上有一质量为m的金属棒ab。导轨一段连接电阻R,其他电阻均不计,磁感应强度为B的匀强磁场垂直于导轨平面向下,金属棒ab在一水平恒力F作用下由静止起向右运动。则
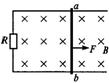
图3-5
A.随着ab动速度的增大,其加速度也增大
B.外力F对ab做的功等于电路中产生的电能
C.当ab做匀速运动时,外力F做功的功率等于电路中的电功率
D.无论ab做何运动,外力F做的功一定等于电路中产生的电能
理科综合能力测试(三)
第Ⅱ卷 (非选择题 共174分)
注意事项:
1.第Ⅱ卷共7页,用钢笔或圆珠笔直接答在试题卷上。
2.答卷前将密封线内的项目填写清楚。
| 题 号 | 22 | 23 | 24 | 25 | 26 | 27 | 28 | 29 | 30 | 31 | Ⅱ卷总分 |
| 得 分 |
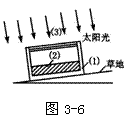
22.(16分)某研究性学习小组的同学为了测定草地在夏天中午单位面积上、单位时间内获得的太阳能,制作了一个太阳能集热装置。实验器材有:
(1)内壁涂黑的泡沫塑料箱一个,底面积为1 m2;
(2)盛水塑料袋一个;
(3)玻璃板一块(约1 m2);
(4)秒表一只(未画出);
(5)台秤一个(未画出).
如图3-6所示,设图下部为一斜坡草地,太阳光垂直照射到草地表面。如果已知水的比热容为c,被水吸收的热量Q与水的质量m、水温升高量△t的关系是Q=cm△t,则为了测定草地在中午单位面积上、单位时间内获得的太阳能,除了需要测量m、△t外,还应测量的物理量是____,缺少的实验仪器是_____,把泡沫塑料箱内壁涂黑的主要目的是_____。本实验会有一定的误差,试写出产生误差的主要原因是_______________。
| 得分 | 评卷人 |
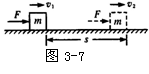 23.(16分)如图3-7所示,设一个物体的质量为m,初速度为v1,在与运动方向相同的恒定合外力F的作用下发生一段位移s。请根据牛顿定律和匀加速运动公式推导出动能定理的表达式并说明表达式的物理意义。
23.(16分)如图3-7所示,设一个物体的质量为m,初速度为v1,在与运动方向相同的恒定合外力F的作用下发生一段位移s。请根据牛顿定律和匀加速运动公式推导出动能定理的表达式并说明表达式的物理意义。
| 得分 | 评卷人 |
24.(18分)(1)可见光的光子“平均能量”是多少?(可看成波长为500 nm的光子的能量)其动量是多少?
(2)一个100 W的电灯泡所放出的能量约有1%的能量由可见光携带,请估计灯泡每秒钟放出可见光光子的数目。
(3)当上述灯泡所发出的光子垂直打在离灯泡2 m处的黑体上时,所产生的光压是多大?(假定灯泡发出光子在各个方向是均匀的)
(提示:光子的动量和波长的关系是![]() )
)
| 得分 | 评卷人 |
25.(20分)如图3-8所示,半径为R的光滑绝缘圆环固定在竖直平面内,在环的底端B点固定一个带正电的小珠,环上还套有一个质量为m,带与小珠等量正电荷的小球。现将小球从A点(半径OA水平)由静止释放开始运动,当运动到C点(∠AOC=30º)时获得的最大动能为Ekm。求:
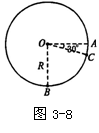 (1)小球在A点刚释放时运动的加速度α;
(1)小球在A点刚释放时运动的加速度α;
(2)小球从位置A运动到位置C的过程中所受静电力做的功W;
(3)小球在位置C时受到圆环对它的作用力。
| 得分 | 评卷人 |
26.(12分)据报道,2003年2月13日四川省又发生一起毒鼠强多人中毒案,控制毒鼠强的使用及寻找新的安全鼠药已成为热点问题。
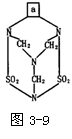
已知毒鼠强由C、H、O、N、S五种元素组成,其原子个数之比为2∶4∶2∶2∶1,其分子结构如图3-9所示。
 试回答:
试回答:
(1)毒鼠强的分子式是____________。
(2)在毒鼠强的分子结构中的方框内a为_______原子团。
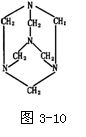
(3)已知在医药上用作抗流感和抗风湿的药物乌洛托品的分子结构如图3-10所示。下列关于乌洛托品与毒鼠强的关系正确的是___________。
A.两者属同系物 B.两者均有剧毒
C.两者都属烃的衍生物 D.两者都可用作药物
| 得分 | 评卷人 |
27.(16分)ClO2是发现最早的氯的氧化物。目前大量用于漂白纸浆和水的处理。ClO2是黄绿色有刺激性气味的气体,沸点11.0℃。它可视为亚氯酸(HClO2)和氯酸的混合酸酐。实验室可用饱和草酸(H2C2O4)溶液与KClO3在60℃反应制得。反应为:![]()
少量的ClO2可用如图3-11装置实验制取(铁架台等辅助仪器省去):
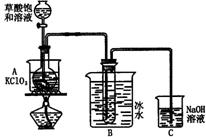
图3-11
(1)A装置还缺少一件仪器,它是______。
(2)生成的ClO2,主要在装置_____中,装置C吸收尾气后生成的主要盐类有①_____,②_____,③_____。A中生成的盐是④_____。
(3)KClO3和浓盐酸在一定温度下反应也会生成ClO2,同时生成Cl2和KCl,其反应的化学方程式为:__________________。
| 得分 | 评卷人 |
28.(18分)反应aA(g)+bB(g)![]() cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
cC(g)+dD(g)在容积不变的密闭容器中达到平衡,且起始时A与B的物质的量之比为a∶b。则
(1)平衡时A与B的转化率之比是_______。
(2)若同等倍数地增大A、B的物质的量浓度,要使A与B的转化率同时增大,(a+b)与(c+d)所满足的关系是(a+b)____(c+d)(填“>”“=”“<”或“没关系”)。
(3)设定a=2,b=1,c=3,d=2,在甲、乙、丙、丁4个容器中A的物质的量依次是2 mol、1 mol、2 mol、1 mol,B的物质的量依次是1 mol、1 mol、2 mol、2 mol,C和D的物质的量均为0。则在相同温度下达到平衡时,A的转化率最大的容器是___,B的转化率由大到小的顺序是____(填容器序号)。
| 得分 | 评卷人 |
29.(16分)铅蓄电池是一种广泛使用的蓄电池。铅蓄电池具有结构简单、维护方便、价格低廉等众多优点,但也存在电流不高、污染较严重等缺点。铅蓄电池在作电源时,以硫酸为电解质溶液。电池放电时反应如下:Pb+PbO2+2H2SO4===2PbSO4+2H2O。下表是不同质量分数的硫酸对应的密度。
| 质量分数 | 0.220 | 0.252 | 0.283 | 0.314 | 0.344 | 0.374 | 0.403 |
| 密度g·mL-1 | 1.155 | 1.180 | 1.205 | 1.230 | 1.255 | 1.280 | 1.305 |
回答下列问题:
(1)写出电池放电时正极的电极反应式:______________。
(2)写出电池充电时阴极的电极反应式:______________。
(3)已知铅蓄电池中硫酸溶液的密度低于1.18 g·mL-1时,将不再放电,此时需要充电;充电过程中,当密度达到1.28 g·mL-1时,电池自行停止充电。现有某经充分充电后的铅蓄电池(设铅蓄电池的容积为2 L,且在充、放电过程中液体体积保持不变),现让该电池充分放电,理论上将释放出多少的电荷量(以电子数目表示)?
| 得分 | 评卷人 |
30.(24分)图3-12是吞噬细胞杀灭细菌的示意图,图中溶酶体含有多种水解酶,它是细胞内的“酶仓库”。请据图回答:
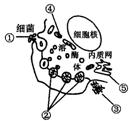
图3-12
(1)图中①过程为内吞作用,③过程为外排作用,①和③过程的进行说明___________。
(2)图中②过程属于_______免疫。
(3)有些毒性很强的细菌经过上述过程不能被清除,只是将内部隐藏的_____暴露出来,呈递给B淋巴细胞或记忆细胞,使之迅速增殖分化成_____。当该细菌在体液中活动时,会被相应的________消灭。该物质是由图中[ ]_____合成。
(4)图中④为上述各生命活动提供____________来源,它从亲代到子代的传递方式为___。
| 得分 | 评卷人 |
31.(18分)图3-13是玉米植株代谢过程示意图,分析回答:
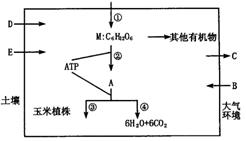
图3-13
(1)玉米与小麦相比,其叶片结构特点是_______________。
(2)图中D、E表示的物质分别是D_____;E_____;
(3)图中M物质形成的场所是_____________;
(4)图中A表示的物质是____________,它是在__________中产生的;
(5)图中未表示出的使①正常进行的非生物因素还有_____________;
(6)写出①过程中电能转换成活跃化学能的反-应式_____________________。
仿真试题(三)
1.C
2.C 质壁分离时,细胞壁与原生质层发生分离,原生质层的最外层结构就是细胞膜。
3.D 神经末梢通过突触小泡释放神经递质。
4.C 5.A
6.A 根据反应CaCO3+2HCl===CaCl2+H2O+CO2↑,烧瓶内物质的质量增加,则烧瓶下沉。
7.D 每步骤涉及的反应类型依次为:分解、复分解、分解。
![]()
8.D 注意CO—CH=CH OH单元的下标为2。
9.C 因题中没有给出CH2=CH-OH→CH3CHO的热效应,故无法判断。
10.D CO2能和Na2CO3反应,除去CO2中混有的HCl应该选用NaHCO3。
11.C 两个反应都可以表示成HX+Y→(HY)X。
12.D Rb的密度比Na和水大,因产生H2而上浮后会比较快地再次沉降,故上下运动的幅度比Na小。
13.D 以④为标准考虑。
14.B 根据原子和原子核的有关概念解答。
15.B 人后退,眼睛的视角变小,观察范围变小。
16.C 根据分子间相互作用力规律、压强的微观解释、温度的意义等考虑。
17.A 同步卫星绕地球转动的周期与地球的自转周期相同。
18.C 根据感应电动势大小所决定的因素来考虑。
19.A 根据串、并联电路特点及交流电的有效值求出结果。
20.C 根据速度的合成和分解,借助矢量关系分析。
21.C 外力F所做的功等于电路中产生的电能和金属棒获得的动能之和。
22.照射时间t 温度计 增强太阳光的吸收 太阳能没有完全被水吸收(每空4分)
23.合外力做功:W=Fs(3分)
根据牛顿第二定律:F=ma(3分)
根据匀加速运动:V22-v12=2as(3分)
解得:![]() (3分)
(3分)
表达式意义:合外力所做的功等于物体动能的变化。(4分)
24.(1)光子能量![]()
由光子的能量和动量的关系可得,光子的动量![]()
也可用![]() (6分)
(6分)
(2)灯泡在可见光区域内辐射能量为N=1%×100 W=1 W,则每秒钟辐射光子数为![]() (个/秒)(6分)
(个/秒)(6分)
(3)光子对黑体的压强,就是黑体在单位面积上每秒钟受到光子冲击时光子动量的改变量。因为光子被黑体吸收,所以动量的改变量在数值上等于光子原来的动量。
以灯泡为球心,2m为半径作一个球面,则球面积S=4πR2
光压![]() (6分)
(6分)
25.(1)小球在C点速度最大时有:
![]()
![]()
所以,刚释放小球有:![]()
![]() (8分)
(8分)
(2)小球从A运动到C,由动能定理:
![]()
![]() (6分)
(6分)
(3)小球在C点,根据圆周运动,有:
![]()
解得:![]() (6分)
(6分)
26.(1)图中给出的C、H、O、N、S原子个数依次为3、6、4、4、2。结合给出的原子个数比,可知a中原子团为CH2。该物质分子式为C4H8O4N4S2。(4分)
(2)CH2(4分)
(3)乌洛托品的分子式为C6H12N14,可知它与毒鼠强既不是同系物也不是同素异形体。答案为C。(4分)
27.(1)反应需要控制温度在60℃,所以还缺少温度计。(3分)
(2)B(3分) Na2CO3(2分) NaClO2(2分) NaClO3(2分) K2C2O4(2分)
(3)2KClO3+4HCl===2ClO2↑+Cl2+2KCl+2H2O(4分)
28.(1)1∶1(4分)
(2)>(4分)
(3)丁 甲>乙>丙>丁(各4分)
29.(1)PbO2+2H2SO4+2e-===PbSO4+SO![]() +2H2O(4分)
+2H2O(4分)
(2)PbSO4+2e-===Pb+SO![]() (4分)
(4分)
(3)根据浓度、质量分数、密度之间的换算关系:
![]() (1分)
(1分)
开始放电时浓度:
![]() (2分)
(2分)
放电结束时浓度:
![]() (2分)
(2分)
放电过程消耗H+的物质的量为:n(H+)=(4.88-3.03)×2=3.7(mol)(2分)
根据放电时关系:2H+~e-
理论上放出的电子总数为1.11×1024个。(1分)
30.(1)细胞膜具有一定的流动性
(2)非特异性
(3)抗原决定簇 效应B细胞 抗体 ⑤ 核糖体
(4)能量 细胞质遗传(每空3分)
31.(1)围绕着维管束的是“花环型”的两圈细胞,内圈为含叶绿体的维管束鞘细胞,外圈为部分叶肉细胞(2分)
(2)水(2分) 矿质元素(2分)
(3)叶绿体基质(2分)
(4)丙酮酸(2分) 细胞质基质(2分)
(5)适宜的光照和温度(2分)
![]()
![]() (6)NADP+H++2e NADPH;ADP+Pi+能量ATP(4分)
(6)NADP+H++2e NADPH;ADP+Pi+能量ATP(4分)
