高三物理第九章气体性质
高考导航
本章研究的是理想气体状态变化的规律。基本规律有玻意耳定律、查理定律、盖•吕萨克定律、理想气体状态方程。问题种类有液柱移动问题、图线问题、能量转化问题等。研究的主要方法有极端分析法、假设法等。通过对以上问题和方法理解和掌握,建立起基本的热学知识体系。本章考查的重点是玻意耳定律、理想气体状态方程和图像问题。题目的特点往往是研究对象不单一,且状态描述复杂。
复习时要在理解概念、规律的同时,清楚各种题型的各自特点与解决方法。液柱移动问题的基本方法是假设推理法,在三个状态量均变化时,可根据情况假设其中一个不变,再运用气体定律进行推理法,在三个状态量均变化时,可根据情况假设其中一个不变,再运用气体定律进行推理,得出矛盾,从而得到正确结论;关联气体问题要分别对各部分气体列出状态方程,再寻求初态和末态各部分气体的体积关系和压强关系,使问题得到求解,该问题是高考热点,同学在复习时要多加练习。图线问题和能量转换问题则经常结合起来考查,此处考查面较广,多以选择题出现,复习时应深入理解图像的物理意义和热力学第一定律中三个量各自由谁决定。
考点精析
一、气体的状态分析
描述气体状态的参量实际上是四个参量:物质的量、温度、体积和压强.
物质的量是气体的化学参量.它反映气体分子数的多少.![]() (M为气体的质量,μ为这种气体的摩尔质量),
(M为气体的质量,μ为这种气体的摩尔质量),![]() (V 为气体体积,Vmol
为该气体的摩尔体积, N为分子总数,阿伏伽德罗常数NA)
(V 为气体体积,Vmol
为该气体的摩尔体积, N为分子总数,阿伏伽德罗常数NA)
温度是气体的热学参量,在热学计算中应采用热力学温标,其它的温标要换算到国际温标上去.常见的是将摄氏温标转换为热力学温标.
体积是气体的几何参量.由于气体总是充满它可以充满的任何空间,所以气体的体积即等于容器的体积.在分析气体的各个状态下的体积变化时,可以通过按照题意画草图的方法把气体的体积变化找出来.
压强是气体的力学参量,气体压强是由大量的无规则运动的气体分子对容器器壁频繁碰撞产生的.气体压强分析是气体状态分析的重点.压强的分析的步骤是:
1.运用受力分析的方法,找到与气体发生作用的物体受到的所有的作用力(其中一定包括所研究的气体对这个物体的作用力).
2.从题意中判断物体的加速度.
3.运用牛顿第二定律求出气体的压强.
二、状态与过程
对于一定质量的气体来说,如果温度、体积和压强这三个量都不改变,我们就说“气体处于一定的状态中”,这里说的状态,应是平衡状态,即平衡态.对于气体当它的质量、温度、体积和压强都不变时,气体就处于一定的状态;一定质量气体的温度、体积和压强当中只要有两个量变化,气体的状态就改变.气体从一个状态变化到另一个状态,都要经历一个过程.这个过程可以很复杂,不过在高中阶段,我们所涉及到的气体状态变化过程都是比较缓慢进行的,可以近似地将这个过程看作是一个个平衡状态的缓慢过渡过程.
用图象能够最直观地展现从一个状态缓慢地过渡到另一个状态所经历的物理过程.

图象中的点表示气体所处的某个状态,线段表示从一个状态到另一个状态所经历的过程.
三、理想气体的模型
从宏观角度看,理想气体就是严格遵循三个气体实验定律的气体.实验表明在常温常压下实际气体可以看作是理想气体.
从微观角度看,可以看成是大量的弹性质点的集合体:
1. 分子自身的线度与分子间距离相比较可以忽略不计;
2. 除碰撞瞬间之外,分子间的作用力可以忽略不计;
3. 分子之间、分子与器壁之间的碰撞是弹性碰撞.
四、
理想气态状态方程的应用:理想气体状态方程有两种表达形式![]() 和
和
![]() 首先应理解两种气态方程的不同的适用范围:
首先应理解两种气态方程的不同的适用范围:![]() 所表示的是定质量的气体发生变化后的两个状态之间的关
所表示的是定质量的气体发生变化后的两个状态之间的关
系.![]() 则表述了任一状态下,理想气体状态参量之间的关系.
则表述了任一状态下,理想气体状态参量之间的关系.
其次:处理问题的基本步骤
1. 确定研究对象是哪一部分气体
2.
确定研究对象的初、末状态,对初、末状态的状态参量做分析一般要注意的是具体问题中的气体质量变不
变,如果气体质量不变就采用理想气体状态方程解决问题;如果气体质量变化就采用克拉珀龙状态方程解决问题.
3.依据气体状态方程代入状态参量进行运算操作.
五、理想气体状态方程的图象的物理意义
p-V 图中线段与体积轴所包围的面积,p-T和V-T图中图线的斜率各有其物理意义.
由![]() ,在p-T图中,
,在p-T图中, ![]() ;在V-T图中,
;在V-T图中, ![]() .对于一定质量的理想气体在p-T图中过原点的线段的斜率与体积成反比;对于一定质量的理想气体在V-T图中过原点的线段的斜率与压强成反比.
.对于一定质量的理想气体在p-T图中过原点的线段的斜率与体积成反比;对于一定质量的理想气体在V-T图中过原点的线段的斜率与压强成反比.
真题解析
1.某同学用同一个注射器做了两次验证玻意耳定律的实验,操作完全正确,根据实验数据却在P、V图上画出了两条不同的双曲线如图9-1所示,造成这种情况的可能原因是( ).
A.两次实验中空气质量不同
B.两次实验中温度不同
C.两次实验中保持空气质量、温度相同,但所取的气体压强的数据不同
D.两次实验中保持空气质量、温度相同,但所取的气体体积的数据不同(2001·上海)

图9—1
[答案](A、B)
[解析] 由克拉伯龙方程可以看出PV=nRT,对于外侧的图线,PV值较大,温度越高和气体的质量越大,图线向外移.只要是质量与温度不变,气体的压强和体积的变化,是在同一条等温线上变化,正确答案为A、B.
说明 除了上面的解法,也可以做一条等压线或者是等容钱,分析两图线的交点,从一个交点变化到另一个交点,也可以得到同样结论.
2.对于一定量的理想气体,下列四个论述中正确的是( ).
A.当分子热运动变剧烈时,压强必变大
B.当分子热运动变剧烈时,压强可以不变
C.当分子间的平均距离变大时,压强必变小
D.当分子间的平均距离变大时,压强必变大 (2000·全国)
[答案](B)
[解析] 影响理想气体的压强的因素有两个,一个是温度,一个是体积,对A、B两选项,由于热运动都加剧,温度升高,但都无法确定气体体积的变化,压强的变化就不一定,B正确,对C、D两项,可判断气体体积变大,但温度的变化是不确定的,压强的变化就不是确定的,C、D两项不能选.
3.一横截面积为S的气缸水平放置,固定不动.气缸壁是导热的,两个活塞A和B将气缸分隔为1、2两气室,达到平衡时1、2两气室体积之比为3:2,如图9-3所示.在室温不变的条件下,缓慢推动活塞A,使之向右移动一段距离d.求活塞B向右移动的距离.不计活塞与气缸壁之间的磨擦. (2000·全国)
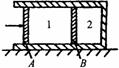
图9—3
[答案](![]() )
)
[解析] 因气缸水平放置,又不计活塞的摩擦,故平衡时两气室内的压强必相等,设初态时气室内压强为p0,气室1、2的体积分别为V1和V2;在活塞A向右移动d的过程中活塞B向右移动的距离为x;最后气缸压强为ρ.因温度不变,分别对气室1和2的气体运用玻意耳定律,得
气室1 p0V1=P(V1-Sd+Sx) (1)
气室2 p0V2=p(V2-Sx) (2)
由(1)、(2)两式解得
![]()
由题意,![]() 得
得![]()
3.如如图9-4所示,某压缩式喷雾器储液桶的容量是5.7×10-3m3.往桶内倒入4.2×10-3m3的药液后开始打气,打气过程中药液不会向外喷出.如果每次能打进2.5×10-4m3的空气,要使喷雾器内空气的压强达到4标准大气压应打气几次?这个压强能否使喷雾器内的药液全部喷完?(设大气压强为1标准大气压) (2000·山西)
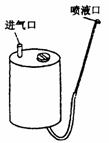
图9—4
[答案](18,能全部喷完)
[解析] 设标准大气压为p0,药桶中空气的体积为V.打气N次以后,喷雾器中的空气压强达到4标准大气压,打入的气体在1标准大气压下的体积为0.25N.则根据理想气体状态方程,
p0V+p0×0.25N=4p0V (1)
其中 V=5.7×10-3-4.2×10-3=1.5×10-3m3
代入数值,解得
N=18 (2)
当空气完全充满药桶以后,如果空气压强仍然大于大气压,则药液可以全部喷出.由玻——马定律,
4p0V=5.7p×10-3 (3)
解得,
p=1.053p0 (4)
所以,药液可以全部喷出.
说明 方程(1)也可以从质量守恒的角度来理解,以所有打入的气体与原有气体的总和为研究对象,由克拉珀龙方程:![]() ,其中M为摩尔质量,则初状态的质量总和与末状态的质量总和保持不变,即:
,其中M为摩尔质量,则初状态的质量总和与末状态的质量总和保持不变,即:
![]() 变形后即为(1)式.
变形后即为(1)式.
在第②问的求解中显然取了一种理想状态,即每次只是喷出药液而空气不随药液出去.
4.麦克劳真空计是一种测量极稀薄气体压强的仪器,其基本部分是一个玻璃连通器,其上端玻璃管A与盛有待测气体的容器连接,其下端D经过橡皮软管与水银容器R相通,如图9-5所示.图中K1、K2是互相平行的竖直毛细管,它们的内径皆为d,K1顶端封闭.在玻璃泡B与管C相通处刻有标记m.测量时,先降低R使水银面低于m,如图9-15(a).逐渐提升R,直到K2中水银面与K1顶端等高,这时K1中水银面比顶端低h,如图9-15(b)所示.设待测容器较大,水银面升降不影响其中压强.测量过程中温度不变.已知B(m以上)的容积为V,K1的容积远小于V.水银密度为ρ
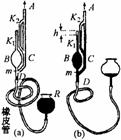
图9—5
(1)试导出上述过程中计算待测压强ρ的表达式.
(2)已知V=628cm3,毛细管直径d=0.30mm,水银密度ρ=13.6×103kg/m3,
h=40mm,算出待测压强ρ(计算时取g=10m/s2.结果保留两位数字).(99.广东)
[答案](1)[![]() (2)p2.4×10-2Pa]
(2)p2.4×10-2Pa]
[解析] (1)水银面升到m时,B中气体刚被封闭,压强为待测压强p.这部分气体末态体积为ah, ![]() 压强为p+hρg,由玻意耳定律,得
压强为p+hρg,由玻意耳定律,得
![]() (1)
(1)
整理得 ![]()
根据题给条件,![]() 远小于V,得
远小于V,得
![]() (2)
(2)
化简得 ![]()
(2)代入数值解得![]()
说明 该题中麦克劳真空计是同学在平常不易接触到的仪器,加上题干文字繁多,条件比较多,怎样从纷繁复杂的条件中提炼出有用的信息条件,对同学的阅读理解能力要求较高.该题的另一难点在于如何利用题给条件.
“待测容器较大,水银面升降不影响其中压强”与“K1的容积远小于V”来进行合理的近似,这就要求同学在复习当中对近似计算有充分的了解.近似计算有题给条件的近似、近似设置物理模型、在计算过程中处理数据的近似等几种,该题显然属于题给条件的近似.
5.如图9-6所示,竖直放置的气缸内盛有气体,上面被一活塞盖住.活塞通过劲度系数k=600N/m的弹簧与气缸相连接,系统处于平衡状态,已知此时外界大气压强ρ0=1.00×105N/m2,活塞到缸底的距离l=0.500m,缸内横截面积S=1.00×10-2m2.今在等温条件下将活塞缓慢上提到距缸底为2l处,此时提力为F=500N,弹簧的原长l0应为多少?若提力为F=700N,弹簧的原长l0又应为多少?
图9—6
不计算摩擦及活塞和弹簧的质量,并假定在整个过程中,气缸不漏气,弹簧都遵从胡克定律
(2002·全国·春招)
[答案](l0=0.833m)
[解析一] 设弹簧的原长为l0,气体原来的压强为p,后来为p',则由玻意耳定律可得
pl=p'·2l, (1)
在原来状态下,活塞受力如图9-35中甲图所示,由力学平衡可得
pS=p0S+k(l-10), (2)
在后来状态下,活塞受力如图乙所示,由力学平衡可得
p'S+F=p0S+k(2l-l0), (3)
由(1)、(2)、(3)联立解得
![]() (4)
(4)
由(2)式得
![]() (5)
(5)
当F=500N时,由(4)式得p=0.4p0,再代入(5)式得l0=1.50m.可见在整个过程中弹簧始终处于压缩状态. 当F=700N时,由(4)式得p=0.8po,再代入(5)式得l0=0.833m.可见在过程开始时弹簧处于压缩状态, 当活塞提到的距缸底距离超过l0=0.833m后,弹簧被拉伸.
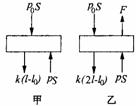
图9—35
[解析二] 设开始时弹簧的压缩量为x(当得出x为负值,则表示开始对弹簧被拉长),原来为l0,依题意得方程:
p0S=pS+kx, (1)
p0S=p'S-k(l0-2x)+F, (2)
p'S·2(l0-x)=pS(l0-x), (3)
l0=l1+x, (4)
由(1)、(2)、(3)、(4)式联立,解得
x=(p0S-2F+2kl)/k, (5)
当F=500N时,代入(5)式,得
x=1.00m,l0=1.50m
当F=700N时,代入(5)式,得
x=0.333m,l0=0.833m.
说明 该题是一道典型的含有弹簧的力热综合题,由于l0与l及2l的大小关系不明.即不明确在初、末状态下弹簧是处在伸长状态还是压缩状态,给确定初、末状态的压强带来不便,也增加了该题的难度,在中学阶段,处理这类问题的方法是先作出假设,然后列方程求解,对初、末状态弹簧的情况假设不同,可能所列方程形式有所不同,但并不影响解题结果.
7.在一密封的啤酒瓶中,下方为溶有CO2的啤酒,上方为纯CO2气体.在20℃时,溶于啤酒中的CO2的质量为mA=1.050×10-3kg,上方气体状态CO2的质量为mB=0.137×10-3kg,压强为ρ0=1标准大气压.当温度升高到40℃时,啤酒中溶解的CO2的质量有所减少,变为m'A=mA-△m,瓶中气体CO2的压强上升到P1:已知: ![]() ,啤酒的体积不因溶入CO2而变化,且不考虑容器体积和啤酒体积随温度的变化.又知对同种气体,在体积不变的情况下
,啤酒的体积不因溶入CO2而变化,且不考虑容器体积和啤酒体积随温度的变化.又知对同种气体,在体积不变的情况下 ![]() 与m成正比.试计算p1等于多少标准大气压(结果保留两位有效数字).
与m成正比.试计算p1等于多少标准大气压(结果保留两位有效数字).
(2001·全国)
[答案](p1=1.6标准大气压)
在400c时,溶入啤酒的CO2的质量为
m'A=mA-Δm
因质量守恒,气态CO2的质量为
m'B=mB+Δm
由题设,
![]()
由于对同种气体,体积不变时,![]() 与m成正比,可得
与m成正比,可得
![]()
由以上各式解得
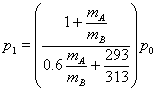
算得
p1=1.6标准大气压
说明 此题提供了一个从未见过的新关系式:m'A/mA=0.60×p1/p0,为我们解决问题提供了新的信息,不能因为与其原有知识结构中的溶液及气休密度与压强的关系等似乎不相通而加以拒绝,仍循定势思维,用原溶液及气态公式求解,那样就走入歧途,问题得不到解.如果用开放的心态,来理解这个关系式,再顺应题设p/T与m成正
比,写出比例式则p1/p0=m'BT0/mBT1再加上题中提下式:m'A=mA-△m,由CO2质量守恒,m'B=mB+△m即可求得.
8.一定质量的理想气体由状态A经过图9-9中所示过程变到状态B,在此过程中气体的密度( ).
A.一直变小 B.一直变大 C.先变小后变大 D.先变大后变小
(2001·全国综合)
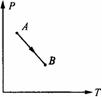
图9—9
[答案](A)
[解析] 分别过A、B两条等容线,可以看出,从A→B体积变大,密度变小.A正确.
9.图9-10中活塞将气缸分成甲、乙两气室,气缸、活塞(连同拉杆)是绝热的,且不漏气.以E甲、E乙分别表示甲、乙两气室中气体的内能,则在将拉杆缓慢向外拉的过程中( ).
A.E甲不变,E乙减小
B.E甲增大,E乙不变
C.E甲增大,E乙减小
D.E甲不变,E乙不变(2000·全国)
![]()
9—10
[答案](C)
[解析] 因为气缸是绝热的,当活塞缓慢向外拉时,甲、乙两团气体与外界不发生热量交换,对甲气体活塞对它做功,内能将增大,而对乙气体则针外做功,内能将减小.
10.有一医用氧气钢瓶,瓶内氧气的压强p=5.0×106Pa,温度t=27℃,求氧气的密度.氧的摩尔质量μ=3.2×10-2kg/mol.(结果取两位数字.) (2000·天津)
[答案](64kg/m3)
[解析] 设钢瓶内氧气的摩尔数为n,体积为V,则有
![]() (1)
(1)
氧气密度
![]() (2)
(2)
由(1)、(2)式联立得
![]() (3)
(3)
以题给数据代入得
![]() (4)
(4)
说明 本题中用到的克拉珀龙方程PV=nRT,在全国高考中不要求.
11.有人设计了一种测温装置,其结构如图9-11所示.玻璃泡A内封有一定量气体,与A相连的B管插在水银槽
中,管内水银面的高度x即可反映泡内气体的温度,即环境温度,并可由B管上的刻度直接读出.设B管的体积与A泡的体积相比可略去不计.
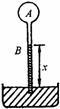
图9—11
(1)在标准大气压下对B管进行温度刻度(标准大气压相当于76cm水银柱的压强).已知当温度t1=27℃的刻度线.管内水银面高度x1=16cm.问t=0℃的刻度线在x为多少厘米处?
(2)若大气压已变为相当于75cm水银柱的压强,利用该测温装置测量温度时所得读数仍为27℃,问此时实际温度为多少? (97·上海)
[答案](21.4cm, 22℃)
[解析] (1)由于B管的体积与A泡体积相比可忽略不计,该过程为等容过程,有
![]()
以P1=76-16=60cmHg T1=273+27=300K
T=273K 代入上式得
![]()
(2)此时A泡内气体压强
![]()
实际
![]()
代入数据得![]() ℃
℃
说明 利用气态方程解决问题时,一定要明确气体状态变化过程,该题的第(1)问,状态变化过程很明确,即A泡内的气体从压强为60cmHg,温度为300K,等容变化到0℃时,由查理定律求出此时压强,就可求出B管中水银柱的高度,从而确定0℃的位置.而对第(2)问中,气体的状态变化,就不是那么明显,读者必须深挖题目隐含条件,进行创设情境,从测温装置上得到的读数为27℃,说明这时B管中的水银柱的高度为16cm,这一定量气体的压强为75-16=59cmHg,设温度为Tx,将这一定量气体等容变化到压强为60cmHg,温度为300K的状态,利用查理定
律,就可求出Tx.也可将这一定量气体等容变化到压强为54.6cmHg,温度为0℃时,再由查理定律求出Tx.
下面我们就给出在标准大气压下对B管进行温度刻度的表达式:
设标准大气压P0=76cmHg,当温度为T1时,水银柱的高度为x1,那么当水银柱高为x时,温度为Tx
![]()
代入数据:![]()
用摄氏温度表示:![]()
例:当x=16cm时 t=27℃
当x=21.4cm时 t=0℃
我们也可以给出,大气压强发生变化时,利用这个温度计测量温度的校正式:设P0为标准大气压,P'为当时的大气压,当温度计的示数为T1时,水银柱高度为x1,校正式为:
![]()
12.如图9-12所示,一水平放置的气缸,由截面积不同的两圆筒联接而成.活塞A、B用一长为3l的刚性细杆连接,它们可以在筒内无摩擦地沿地沿水平方向左右滑动.A、B的截面积分别为SA=30cm2、SB=15cm2.A、B之间封闭着一定质量的理想气体.两活塞外侧(A的左方和B的右方)都是大气,大气压强始终保持为P0=1.0×105Pa.活塞B的中心连一不能伸长的细线,细线的另一端固定在墙上.当气缸内气体温度为T1=540K,活塞A、B的平衡位置如图所示,此时细线中的张力为F1=30N.
![]()
图9—12
(1)现使气缸内气体温度由初始的540K缓慢下降,温度降为多少时活塞开始向右移动?
(2)继续使气缸内气体温度下降,温度降为多少时活塞A刚刚右移到两圆筒联接处?
(3)活塞A移到两圆筒联接处之后,维持气体温度不变,另外对B施加一个水平向左的推力,将两活塞慢慢推向左方,直到细线拉力重新变为30N.求此时的外加推力F2是多大. (2001·北京·春招)
[答案](450K,270K,90N)
[解析] (1)设气缸内气体压强为P,F为细线中的张力,则活塞A、B及细杆这个整体的平衡条件为P0SA-PSA+PSB-P0SB+F=0
解得![]() ①
①
对于初始状态,F=F1=30N,
代入①式,就得到气缸中气体的初始压强
![]()
由①式看出,只要气体压强P>P0,细线就会拉直且有拉力,于是活塞不会移动,使气缸内气体温度降低是等容降温过程,当温度下降使压强降到P0时,细线拉力变为零,再降温时活塞开始向右移,设此时温度为T2,压强P2=P0,有
![]() ②
②
得 T2=450K ③
(2)再降温,细线松了,要平衡必有气体压强P=P0,是等压降温过程,活塞右移,体积相应减小,当A到达两圆筒联接处时,温度为T3,
![]() ④
④
得 T3=270K ⑤
(3)维持T3=270K不变,向左推活塞,是等温过程,最后压强为PA,
有![]() ⑥
⑥
推力F2向左,由力的平衡条件得
![]() ⑦
⑦
解得 F2=90N ⑧</P< p>