北京市2006年高级中等学校招生统一考试
化学模拟试卷(一)
| 题号 | 一 | 二 | 三 | 四 | 总分 |
| 分数 |
可能用到的相对原子质量:H-1 O-16 N-14 Cl-35.5 S-32 Mg-24 Al-27 Ca-40
Na-23 Fe-56 Zn-65 K-39 Cu-64 Ag-108
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | |||||||
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | |||||||
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 | |||||||
| 题号 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 答案 | |||||||
| 题号 | 29 | 30 | 31 | 32 | 33 | 34 | 35 |
| 答案 |
一、选择题(共35分,每小题1分。每小题只有一个选项符合题意,将其正确的标号填在上表相应的位置中)
1、 生活中发生的下列变化,属于物理变化的是:
(A)煤气燃烧 (B)铁被磁化
(C) 菜刀生锈 (D)牛奶变酸
2、下列物质,属于纯净物的是:
(A)矿泉水 (B)生铁
(C)稀硫酸 (D)干冰
3、在某些食品包装袋内,常装有一个标有“干燥剂”的小袋,袋内装有生石灰固体,该物质属于:
(A)酸 (B)碱
(C)盐 (D)氧化物
4、下列常见食品中,呈弱碱性的是:
(A)泡菜(pH 3.2~3.6 ) (B)牛奶(pH 6.3~6.6)
(C)鸡蛋清(pH 7.6~8) (D)苹果(pH 2.9~3.3 )
5、熟石灰在日常生活中和工农业生产中有广泛的用途,下列关于熟石灰的用途中,说法不正确的是:
(A)作建筑材料 (B)改良酸性土壤
(C)制农药波尔多液 (D)治疗胃酸过多
6、下列各组物质在氧气中燃烧,前者产生明亮蓝紫色火焰,后者有浓厚白烟生成的是:
(A)硫粉、白磷 (B)镁带、红磷
(C)蜡烛、木炭 (D)纸张、铁丝
7、发展绿色食品,避免“白色污染”,增强环保意识,是保护环境、提高人类生存质量的主要措施,通常所说的“白色污染”是指:
(A)冶炼厂排放的白色烟雾 (B)石灰窑放出的白色粉尘
(C)聚乙烯等白色塑料垃圾 (D)白色建筑垃圾
8、每年的5月13日是世界无烟日。香烟的成分很复杂,燃烧产生的烟气中含有许多强致癌物质和有害物质,其中对人体危害最大的分别是尼古丁(化学式为C10H14N2)、焦油、一氧化碳等。下列说法错误的是:
(A)吸烟严重危害身心健康
(B)尼古丁中碳、氢、氮三种元素质量比为60:7:14
(C)尼古丁中含有10个碳原子,14个氢原子和2个氮原子
(D)一氧化碳能与血液里的血红蛋白结合,故而有剧毒
9、曾用作麻醉剂的“笑气”是一种氮氧化物,其中氮元素的化合价为+1价,“笑气”的化学式是:
(A)N2O5 (B)NO2
(C)NO (D)N2O
10、大气中的臭氧层可滤除大量的紫外线,保护地球上的生物。下列关于臭氧
(化学式为O3)的说法正确的是:
(A)3个氧原子构成1个臭氧分子
(B)O3和O2均由同一种元素组成,它们混合在一起仍属于纯净物
(C)空气中含有大量的臭氧
(D)臭氧的性质与氧气完全相同
11、减少“酸雨”产生的措施:①少用烟煤作燃料②把工厂烟囱建高
③将钢窗换成塑钢的④燃料脱硫⑤开发利用氢能源。其中有效措施是:
(A)①②③ (B)②③④
(C)①④⑤ (D)①③④
12、考古学家是通过测定古生物遗骸中碳-14含量来推断它的生活年代。
下列关于碳-14原子的说法中,错误的是:
(A)中子数为6 (B)质子数为6
(C)电子数为6 (D)质子数和中子数之和为14
13、混合物分离的方法在生产、生活和科学实验中有着广泛的应用。下列做法中应用了结晶方法的是:
(A)除去水中的泥沙 (B)分离豆浆和豆渣
(C)除去混在铜粉中的铁粉 (D)用海水晒盐
14、下列反应中,在反应类型上与其它三种不同的一个是:
(A)H2和O2 (B)Zn和H2SO4溶液
(C)H2和CuO (D)Fe和Cu SO4
15、对下列实验过程的评价,正确的是:
(A)某固体加入稀盐酸,产生无色气体,证明该固体一定含有CO32-
(B)某无色溶液滴入酚酞试液显红色,该溶液不一定是碱溶液
(C)某溶液中滴加BaCl2溶液,产生不溶于稀HNO3的白色沉淀,
该溶液中一定含有SO42-
(D)验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加AgNO3溶液,有白色沉淀出现,证明含有Cl-
16、已知碳有如下性质:![]() 由此可知在火势旺盛的煤炉中填加湿煤火焰将会:
由此可知在火势旺盛的煤炉中填加湿煤火焰将会:
(A)不旺 (B)更旺
(C)熄灭 (D)维持不变
17、下列物质在敞口容器中放置一段时间后,质量增加并有新物质产生的是:
(A)浓硫酸 (B)苛性钠固体
(C)浓盐酸 (D)碳酸钠晶体
18、氯气用于自来水的消毒和杀菌,其与水的反应式为:Cl2+H2O→HCl+HClO请选择一种试剂来证明某瓶水是蒸馏水还是自来水:
(A)酚酞试液 (B)氯化钡溶液
(C)氢氧化钠溶液 (D)硝酸银溶液
19、下列说法正确的是:
(A)含氧的化合物都是氧化物
(B)降低饱和溶液的温度后,溶液中溶质的质量分数保持不变
(C)蒸发滤液时,只要等蒸发皿中出现多量固体时就可停止加热
(D)图书档案室起火,用液态二氧化碳灭火器扑灭
20、纳米材料被誉为21世纪最有前途的新型材料。纳米碳管是一种由碳原子构成的
直径为几个纳米(1nm=10-9m)的空心管。下列说法错误的是:
(A)纳米管是一种新型的化合物材料
(B)纳米管具有管道多,表面积大,吸附能力强的性质
(C)纳米管在常温下化学性质稳定
(D)纳米管材料如果完全燃烧,生成物是二氧化碳
21、下列各组物质可在同一溶液中大量共存,且形成无色溶液的是:
(A)NaOH HCl NaCl (B)CuCl2 Na2SO4 KNO3
(C)BaCl2 KOH NaNO3 (D)CaCl2 Na2CO3 NaCl
22、某同学在实验室设计了下列四种制取气体的方法:
①用铁和浓硫酸反应制取氢气
②用氯酸钾和高锰酸钾混合加热制取氧气
③用大理石和稀硫酸反应制取二氧化碳
④用煤、木炭燃烧产生二氧化碳。
这四种设计中,方法正确且易操作的是:
(A)①②③④ (B)②④
(C)①② (D)②
23、在化学反应xM+yN→mP+nQ中,下列说法正确的是:
(A)若P、Q为盐和水,则该反应一定是中和反应
(B)系数x与y之和一定等于m与n之和
(C)若取a克M与b克N反应,生成P和Q的质量总和一定等于(a+b)克
(D)若M、P为单质,N、Q为化合物,则该反应一定是置换反应
24、分离氯化铁、氯化纳、硫酸钡的固体混合物,得到三种纯净物,
应选用的一组试剂是:
(A)水、硝酸银、稀硝酸 (B)水、氢氧化钠、盐酸
(C)水、氢氧化钠、稀硝酸 (D)水、氢氧化钾、盐酸
25、现有A、B、C三种金属,C能与稀盐酸反应放出氢气,而A、B不能;把A放在B的硝酸盐溶液中,A表面有B析出。三种金属的活动性顺序有强到弱的是:
(A)A>B>C (B)B>C>A
(C)C>A>B (D)C>B>A
26、将下列溶液分别滴入NaOH、Ba(OH)2溶液和稀硫酸中,产生三种不同现象的是:(A)FeCl2溶液 (B)KNO3溶液
(C)Na2CO3溶液 (D)无色酚酞试液
27、下列四个图像分别表示对应的四种操作过程,其中正确的是:
(A)加热等质量的氯酸钾制氧 (B)含有水蒸气的氢气通过浓硫酸
![]()
![]()
![]()
 (C)引淡水浸泡盐碱地
(D)向硝酸钡溶液中滴加稀硫酸
(C)引淡水浸泡盐碱地
(D)向硝酸钡溶液中滴加稀硫酸
28、三种都能与酸反应的金属共2.3克,与足量的稀盐酸反应,生成氢气0.1克。
则这三种金属可能是:
(A)Mg、Na、Al (B)Zn、Na、Fe
(C)Zn、Na、Al (D)Cu、Na、Al
29、下列各组溶液,不用其它试剂就不能将其鉴别开来的是:
(A)Na2SO4 Na2CO3 BaCl2 HCl (B)Na2SO4 BaCl2 KNO3 NaCl
(C) NaCl HCl NaOH 酚酞 (D)NaOH H2SO4 FeCl3 MgCl2
30、液化石油气作为燃料,已普遍进入城乡家庭,它是含有下列物质的混合物,
在常压下,这些物质的沸点如下表所示:
| 物质名称 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | 己烷 |
| 沸点/℃ | -88.6 | -42.2 | -0.5 | 36.1 | 69.2 |
在常温下使用至无气体放出时,钢瓶中常剩余的物质是:
(A)戊烷和己烷 (B)乙烷和丙烷
(C)只有己烷 (D)乙烷、丙烷和丁烷
31、某化合物的化学式为AB2型,则元素A、B的原子结构示意图可能是:
① ② ③ ④
(A)①③ (B)③④
(C)②③ (D)①④
32、将含有硫酸的硫酸镁溶液转变为中性溶液,在没有任何指示剂的条件下,可选用:
(A)NaOH (B)Mg
(C)Ba(OH)2 (D)BaCl2
33、在天平两边的托盘上各放一个盛有某质量分数相同,质量也相同的盐酸的烧杯,
此时天平平衡。先将下列物质按前后质量比为10:21的比例放入烧杯中,
反应都恰好完全,天平仍平衡的是:
(A)Mg和MgO (B)MgO和Mg(OH)2
(C)MgO和MgCO3 (D)Mg和MgCO3
34、一般情况下,难溶于水的碱受热可分解生成对应的氧化物和水,现有下列变化:
则A可能是:
(A)CO2 (B)Na2O
(C)CaO (D)CuO
35、下列括号内的气体是需要检验的杂质,检验方法合理的是:
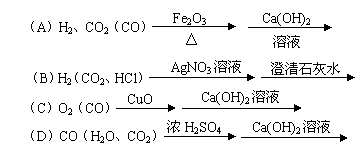 |
二、填空题(共23分)
36、(2分)2003年10月15日,中国发射“神州五号”载人飞船,向全世界人民展示我国先进的空间科学技术。在发射飞船的“长征”二号F型火箭推进器中有强还原剂肼(N2H4)和强氧化剂NO2,当其混合即产生大量N2和水蒸汽,并放出大量热。其化学方程式________________________。
如果用过氧化氢(H2O2)代替NO2用于火箭推进剂,除能释放大量热和快速反应产生气体外,还有一个最突出的优点是_____________________________________。
37、(6分)某教师向同学们介绍氨气(NH3)是一种具有还原性的气体,做了如下试验,装置图如下:将氨气通入装有黑色粉末y的玻璃管A中,加热,当黑色粉末全部转化为光亮的红色固体时,U型管B中的白色固体变为蓝色Z,同时集气瓶C中收集到一种无色的气态单质X。
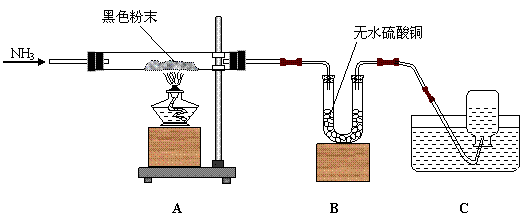 |
(1)请写出下列物质的化学式x__________y_________z___________
(2)请写出A装置中反应的化学方程式_________________________
(3)请写出B装置中反应的化学方程式_________________________
(4)将少量的镁条与单质X在点燃的条件下化合,则单质X中元素的化合价由零价变为负三价,请写出反应的化学方程式_________________________
38、(1分)小明家里卫生间的水龙头正下方瓷砖上有黄褐色斑痕,用湿抹布擦不干净,请你用所学到的化学知识除去斑痕,简单说出你的办法:
__________________________________________________。
39、(2分)在澄清的石灰水中滴入2~3滴酚酞试液,出现红色。放置一段时间后,
红色逐渐消失,请你对此现象进行合理的解释:__________________________________________________。
40、(1分)将铁和锌的混合物粉末加入到硫酸铜溶液中,当铁和锌全部溶解后,此时溶液的质量没有变化,则参加反应的铁和锌的质量比为____________。
41、(5分)在盛有无色Ba(OH)2溶液的试管里逐一加入A、B、C三种溶液,依次发生下例实验现象:
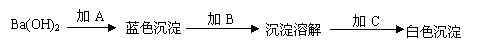
若A、B、C可从硫酸、盐酸和氯化铜三种溶液中选择,请根据实验现象判断并
写出A、B、C及蓝色沉淀和白色沉淀的化学式:A_________B_________C____________蓝色沉淀_________白色沉淀_________。
42、(6分)有一包白色粉末,可能由NaCl、Na2SO4、Na2CO3、MgCl2、FeCl3中的一种或几种组成。现做如下试验:①取少量粉末加水溶解,得到无色透明溶液;②取①中所得溶液少许加入NaOH溶液,无明显现象;③另取少量粉末,滴加稀盐酸,也无明显现象。请问:
(1)由实验①可知,原粉末中没有_________;实验②可证明原粉末中没有_________;实验③可证明原粉末中没有_________。(填化学式)
(2)根据上述实验,请判断原粉末中可能有的物质是 。
(3)为进一步探究原粉末中的成分,按下图试验:(提示:在AgNO3、BaCl2、Ba (NO3)2中选择两种作为A、B试剂,且A、B的阳离子不同)

用化学式填写:粉末成分________________;试剂A__________;试剂B__________。
三、实验题(共14分)
43、(3分)有一杯接近饱和的Ca(OH)2溶液,可采用__________、__________、__________使其变为饱和溶液。
44、(4分)实验室有失落标签的4瓶无色溶液:MgCl2、NaCl、HCl、NaOH,现实验桌上只有1瓶酚酞试液。请你设计只用瓶酚酞试液鉴别上述溶液的实验方案。
| 实验设计方案 | |
| 实验步骤 | 预计产生的实验现象和由此得出的结论 |
| (1) | |
| (2) | |
45、(7分)某日报有题为“学校化学实验室也是污染源”的报道,文章指出:全国数以万计的高校、中学的化学实验室每天都排放着成分复杂的污染物。为此某校化学研究小组拟进行如下试验,以粗略测试刚做完实验的实验室(甲)空气中全部酸性气体的含量。
 |
步骤:
(1)取样:因试验在另一间没有污染的实验室(乙)中进行,请你设计取出适量化学
实验室(甲)空气样品的方法: 。
(2)按图装置取得的气体进行实验,问:图中装置A的作用是______________________
装置C的作用是______________________________________。
若酸性气体中含有二氧化硫,请写出其在A装置中反应的化学方程式:
______________________________________________________。
(3)计算:若取样气体为100毫升,装置C读数为99.0毫升,则实验室(甲)空气中总酸性气体体积含量约为_________%。
分析:①一般空气中含二氧化碳约为0.03%,此样品中由实验室废气产生的
酸性气体约为_________%。
②请提出你在进行化学实验时,减少实验室对人类生存环境污染的一种做法:
____________________________________________________。
四、计算题(共8分)
46、(2分)从200毫升质量分数为60%(密度为1.5g/cm3)的硫酸溶液中取出50毫升,这50毫升中所含溶质质量为________克,将这50毫升硫酸溶液稀释成质量分数为20%的硫酸溶液,需加水________毫升。
47、(6分)取145mL稀盐酸(密度为1.1g/cm3),跟53g含杂质(该杂质不与盐酸、生成物反应,也不溶于水)的石灰石恰好完全反应,生成19.8g二氧化碳。计算:
(1)所用稀盐酸中HCl的质量分数;
(2)石灰石中含碳酸钙的质量分数;
(3)生成物溶液中,溶质的质量分数。
答案
一、选择题(共35分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 答案 | (B) | (D) | (D) | (B) | (D) | (A) | (C) |
| 题号 | 8 | 9 | 10 | 11 | 12 | 13 | 14 |
| 答案 | (C) | (D) | (A) | (C) | (A) | (D) | (A) |
| 题号 | 15 | 16 | 17 | 18 | 19 | 20 | 21 |
| 答案 | (B) | (B) | (B) | (D) | (D) | (A) | (C) |
| 题号 | 22 | 23 | 24 | 25 | 26 | 27 | 28 |
| 答案 | (D) | (D) | (B) | (C) | (C) | (C) | (A) |
| 题号 | 29 | 30 | 31 | 32 | 33 | 34 | 35 |
| 答案 | (B) | (A) | (B) | (B) | (C) | (D) | (B) |
二、填空题(共23分,每空1分)
36、2N2H4+2NO2→3N2+4H2O,产物为水,对环境无污染。
37、 (1)x:N2 y:CuO z:CuSO4·5 H2O
(2)![]()
(3)CuSO4+5 H2O →CuSO4·5 H2O
(4)![]()
38、用刷子沾醋擦洗(其它答案合理也给分)
39、氢氧化钙与空气中CO2反应生成碳酸钙和水,溶液变成中性
40、7:65
41、A:CuCl2 B:HCl C:H2SO4 Cu(OH)2 BaSO4
42、(1)FeCl3 MgCl2 Na2CO3 (2)NaCl Na2SO4
![]() (3)
粉末成分: Na2SO4 试剂A:Ba(NO3)2 试剂B: AgNO3
(3)
粉末成分: Na2SO4 试剂A:Ba(NO3)2 试剂B: AgNO3
NaCl 试剂A: AgNO3 试剂B: Ba(NO3)2
三、实验题(共14分)
43、加溶质、蒸发溶剂、升温。
44、
| 实验设计方案 | |
| 实验步骤 | 预计产生的实验现象和由此得出的结论 |
| (1)分别取样,滴加酚酞试液 | 变红色的溶液是NaOH |
| (2)取上述滴有酚酞试液的NaOH溶液,分成3份,分别加入3种未知溶液 | 产生白色沉淀的原溶液是MgCl2,红色褪去的原溶液是HCl溶液,无明显变化的原溶液是NaCl溶液 |
45、步骤:(1)使用注射器;或使用装满水的瓶子,进入实验室后倒去水,用干布擦拭;或使用气囊等。(2)吸收样品中的酸性气体 测量吸收酸性气体后剩下气体的粗略体积 2NaOH+SO2→Na2SO3+H2O
(3)1%分析:①0.97%;②控制实验室药品用量;不乱倒废液、乱扔废物等。
四、计算(共8分)
46、45 150
47、解:稀盐酸的质量:1.1g/cm3×145mL=159.5g
设参加反应的CaCO3和HCl的质量分数为x、y,生成CaCl2的质量为z。
CaCO3+2HCl→CaCl2+CO2↑+2H2O
100 73 111 44
x y z 19.8g
解得:x=45g,y=32.9g,z=49.95g
(1) ω(HCl)=(32.9/159.5) ×100%=20.6%
(2) ω(CaCO3)=(45/53) ×100%=84.9%
(3)质量守恒定律:m(CaCO3)+ m(HCl)= m(CaCl2)+m(CO2)+m(杂质) ,则CaCl2溶液质量为53+159.5-19.8-(53-45)=184.7g,CaCl2溶液中,
ω(CaCl2)=(49.95/184.7)×100%=27.0%
答:略。