![]() 2005年河南省课改实验区中招测化学试卷
2005年河南省课改实验区中招测化学试卷
相对原子质量:H-1 C-12 N-14 Na-23 S-32 Cl-35.5 Ca-40 Fe-56 Cu-64
一、 选择题(每小题只有一个选项正确,每小题1分,共12分)
1、学习化学可以防止走入生活和学习的误区。下列认识不正确的是
A苛性钠不是钠,而是一种常见的碱
B发明一种催化剂可以使水变成燃油
C “绿色食品”并不是指颜色一定是绿色的食品
D“白色污染”是指一些难分解的“塑料垃圾”对环境的污染
2、下列物质的用途只与其物理性质有关的是
A干冰可作致冷剂用于人工降雨 B氢气可作清洁燃料
C食醋可除去水壶中的水垢 C熟石灰可用于改良本性土壤
3、下列物质中前者属于混合物,后者属于音质的一组是
A冰水混合物 氮气 B乙醇汽油 天然气 C纯碱 氧气 D 空气 水银
4、在擦玻璃时,人们时常先向玻璃上“哈气”再擦会使玻璃擦得更干净。这说明与空气相比,人体呼出的气体中含有较多的
A CO2 B N2 C H2O D O2
5、下列说法正确的是
A用肥皂水可区分硬水和软水 B硬水有污染物而软水中无污染物
C水不属于人类重要营养之一 D地球上淡水资源是取之不尽用之不竭的
6、下列物质溶于水能使溶液的温度显著降低的是
A NaCl B NH4NO3 C NaOH D浓H2SO4
7、可以一次鉴别出空气、氧气和二氧化碳三瓶气体的最合适的方法是
A分别加入适量石灰水 B分别滴入紫色石蕊溶液
C将燃着的木条分别伸入瓶中 D将气体分别通过灼热的铜丝网
8、“绿色化学”是当今社会提出的一个新概念。它包括“原料的绿色化”、“化学反应的绿色化”、“产物的绿色化”等内容。其中“化学反应的绿色化”,是指参加反应的物质中的所有原子完全被利用且全部转化到欲制得的产品中。下列化学反应符合“化学反应的绿色化”要求的是
A 用锌和稀硫酸反应制取氢气
B在高温下用一氧化碳和氧化铜反应制取金属铜
C用氢氧化钙和碳酸钠反应制取少量氢氧化钠
D用金属镁和氧气在点燃的条件下反应制取少量氧化镁
9、多数食品容易吸收空气中的水分变潮湿,并与空气中氧气反应而腐败。生产上常采用在食品袋中放入一小包CaO粉末的方法,以使食品保持干燥。目前发现食品袋中放入一小包铁粉(包裹在多孔泡沫中)也能保护食品。下列说法不正确的是
A 生成的铁锈是一种混合物
B铁粉干燥剂与水和氧气发生化学反应
C两种干燥剂袋上都要有明显的“勿食”字样
D CaO干燥剂在空气中失效后的最终产物为Ca(OH)2
10、X、Y、Z是三种金属音质,其中只有X可以与稀硫酸反应产生氢气。将Z投入到Y的盐溶液中,发现Z的表面有Y析出。则X、Y、Z三种金属的活动性顺序按由强到弱的顺序排列正确的是
A X>Y>Z B Z>X>Y C X>Z>Y D Z>Y>X
11、下列化学方程式与事实不相符的是
A高温煅烧石灰石:CaCO3 高温 CaO+CO2↑
B用铁和硫酸铜溶液反应制备铜:Fe+CuSO4=Cu+FeSO4
C用一氧化碳还原氧化铁炼铁:Fe2O3+3CO 高温 2Fe+3CO2
D用氢氧化镁治疗胃酸过多症:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
 12、某同学用下图所示的装置测定空气中氧气的含量,实验后发现所测定氧气的体积分数低于1/5,针对这一事实,你认为下列做法或想法不正确的是
12、某同学用下图所示的装置测定空气中氧气的含量,实验后发现所测定氧气的体积分数低于1/5,针对这一事实,你认为下列做法或想法不正确的是
A查看实验装置是否漏气
B将红磷改为蜡烛再重做实验
C 实验中红磷的量可能不足,没有将瓶内的氧气消耗完全
D反应后未冷却至室温就打开止水平,使进瓶内的水的体积减少
二、填空题(每空1分,共16分)
13、请运用所学知识解释生活中的一些现象和做法:
(1)墙内开花,墙外可闻到花香,其原因是________________。
(2)炸油条时,当面轩放油锅后,面团中的小苏打(NaHCO3)受热分解生成碳酸钠、水和二氧化碳,不断产生的二氧化碳会使油条膨胀并浮出油面。其中的化学反应可用化学方程式表示为_______________________________。
(3)铁制暖气片上常常涂刷有“银粉”(铝粉)其原因是________________。
14、氨水在农业生产上可用作化学肥料。某同学取氨水少许。向其中滴入几酚酞溶液后,发现溶液显红色,由此推断,氨水的pH____7(填“>” “=” “<”).
15、用化学符号填写下列空白:
+5价的磷的氧化物_________;由空气中含量占第二位的元素和地壳中含量第二的金属元素所形成的化合物(只要求写出一种)__________。
16、分别选用一种试剂除去下列物质中的杂质(括号内的物质为杂质)
O2(CO2)_______;CaCl2(CaCO3)_______
17、(1)煤是重要的化工原料,也是居民在冬天取暖的主要能源之一,煤中含有硫元素,燃烧时产生的二氧化硫气体会造成大气污染。某居民家中冬天取暖需用煤1000kg,若煤中含硫约2%,则该居民家中整个冬天向大气排放约____kg二氧化硫。(2)人类对煤和石油等化石燃料的大量开采和使用,已使其面临枯竭。请列举两种有待继续开发、利用的能源_______.(3)有人发现厨房中煤气或液化石油气泄漏。立即打开换气扇或抽油烟机的开关将可燃气体排出室外,这样做是不安全的!其原因是__________________________________。
18、下图是某同学配制30.0g质量分数为6%的食盐水的全过程:
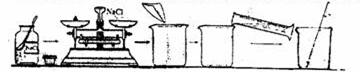
(1)请找出图中的错误并加以改正(答出两处即可)(2)若操作正确,配制时需量取水的体积为____mL(水的密度为1.0g/mL).(3)如果配制的食盐水中NaCl的质量分数小于6%,则可能造成误差的原因有(答出两条即可)
三、简答题(共12分)
19、某同学根据“铁生锈后质量会增加”,推断出质量守恒也有例外。你认为该同学的观点正确吗?请加以解释。
20、在化学实验中,常常依据反应伴随的现象来确定反应是否发生。请分别写出伴有发光、放出气体、生成沉淀的不同现象的三个化学反应方程式。
21、(1)如何使一定量的氢氧化钙固体尽快溶解在水中,请提出你的操作建议。(2)若将少量生石灰加入到某氢氧化钙的饱和溶液中,保持温度不变,所得溶液的质量和溶质的质量分数与原溶液相比有变化吗?(有变化的需指出变大还是变小)
22、某化学课外活动小组利用下列装置制取气体。
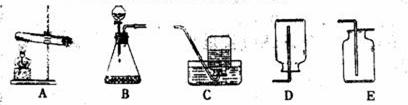
(1)利用以上装置可制取的气体有哪些?写出有关制取原理的化学方程式。(要求答出两种气体)(2)实验室选择气体发生装置应考虑的因素有哪些?(3)甲烷(CH4)在通常状况下是一种无色、无味的气体,密度比空气小,极难溶于水。实验室常用加热无水醋酸钠和碱石灰两种固体物质的混合物来制取甲烷。试确定实验室制取甲烷应选用以上哪种发生装置和收集装置?
四、综合应用题(共10分)
23、某化工厂制取硝酸铜有下列两种途径:
A、铜与稀硝酸反应,反应的化学方程式:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O生成的一氧化氮在空气中很容易被氧化成二氧化氮。
B、铜与浓硝酸反应,该反应的化学方程式:Cu+4HNO3(浓)=Cu(NO3)2+2X↑+2H2O
试确定X的化学式为________________。
请回答:(1)一氧化氮、二氧化氮是大气污染物,在生产中要尽可能减少排放。判断:若要制得质量的硝酸铜,以上哪种途径较好,说明理由。
(2)根据所学知识,请设计制取硝酸铜更合理的途径。并写出有关反应的化学方程式。
(3)若取6.4g铜加入到50g的一定质量分数的稀硝酸中,恰好完全反应。计算: 可以制得的硝酸铜的质量是多少? 原稀硝酸中溶质的质量分数。
答案
一、1、B 2、A 3、D 4、C 5、A 6、B 7、C 8、D 9、D 10、C 11、D 12、B
二、13、分子是在不断运动的 (2)2NaHCO3=Na2CO3+H2O+CO2↑
(3)铝在空气中易与氧气反应形成致密的氧化膜,对铁制暖气片起保护作用,可以防止铁生锈 14、> 15、P2O5 FeO、Fe2O3 Fe3O4中的一种 16、NaOH或Ca(OH)2等碱性溶液 HCl或H2O 17、(1)40 (2)氢能、核能、太阳能、风能、地热能、潮汐能等。(3)打开电器开关时产生的电火花会引燃可燃气体而造成爆炸 18、(1)药品的瓶盖放置错误,应该倒放在桌面上 托盘天平上的砝码和药品放反了,应该是左物右码。 用温度计搅拌不对,应该用玻璃棒搅拌 (2) 28.2 (3) 氯化钠中有杂质 水量多了 天平称量的固体偏少 计算错误 (其他合理答案均可)
三、简答题 19、不正确。铁生锈是因为铁和空气中的水、氧气等作用,发生了化学变化,参加反应的铁、氧气和水等物质的质量之和与反应后生成铁锈的质量相等。
20、发光:C+O2点燃CO2
放出气体:Zn+H2SO4=ZnSO4+H2↑
生成沉淀:Ca(OH)2+CO2=CaCO3↓+H2O(其他合理答案均可)
21、(1)搅拌、降温、粉碎固体等(答出一种即可)
(2)溶液的质量将减小 溶质的质量分数保持不变
22、(1)制取氧气 2H2O2 MnO2 2H2O+O2↑
制取二氧化碳:CaCO3+2HCl=CaCl2+H2O+CO2↑
(2)反应物的状态和反应的条件
(3)制取装置选A:收集装置选C或D
四、综合应用题
23、 X的化学式为NO2
(1)途径A较好,因为要制取等质量的硝酸铜,途径A消耗的原料相对较少,产生的污染气体也相对少一些。
(2)先将铜在空气中加热转化成氧化铜,然后用氧化铜和硝酸反应制得硝酸铜。2Cu+O2=2CuO CuO+2HNO3=Cu(NO3)2+H2O
(3)解:设与6.4g铜恰好完全反应的硝酸的质量为x,生成硝酸铜 的质量为y,
3Cu + 8HNO3(稀) = 3Cu(NO3)2+2NO+4H2O
3×64 8×63 3×188
6.4g x y
则:x=16.8g y=18.8g (16.8÷50g)×100%=33.6%
答:可制得硝酸铜的质量是18.8g。