广东省茂名市2005年中考化学试题-新课标
(满分100分,考试时间60分钟)
相对原子质量:H-1 O-16 Mg-24 Cl-35.5 Fe-56
第1卷(选择题,共30分)
一、选择题(本题有10小题。每小题3分。共30分。每小题只有一个选项符合题意)
1.减少大气和水污染,重视我市“碧水蓝天”,下列措施不可行的是 ( )
A.禁止工厂排放工业废水 B.少用或不用含磷洗涤剂
C.植树造林,扩大绿化面积 D.推广使用清洁燃料
2.下列说法正确的是 ( )
A.清新空气属于纯净物 B.活性炭吸附毒气属于化学变化
C.塑料属于合成材料 D.人体缺碘会引起贫血
3.N2O俗称“笑气”,曾在十九世纪被人们用作手术上的麻醉剂。N20中氮元素的化合价是 ( )
A.+1 B.+2 C.+3 D.+4
厨房中有许多与化学知识有关的问题,结合所学知识回答4.8题。
4.炒菜煮饭时,满屋飘香,这一现象说明 ( )
A.分子是有香味的 B.分子可分裂成原子
C.分子在不停地运动 D.分子之间有一定间隔
5.炒菜时油锅起火,应采取的措施是 ( )
A.向油锅泼水 B.赶快跑开
C.用扇向油锅扇风 D.用锅盖盖紧油锅
6.厨房中有下列食物,其中含有丰富蛋白质的是 ( )
A.米饭 B.瘦肉 C.白菜 D.花生油
7.我们常吃的云吞往往带点苦涩的味道,原因是它在制作过程中加入了“碱水”(呈碱性的物质)。为减少苦涩味,在吃云吞时,最好醮点以下哪种物质 ( )
A.食醋 B.食盐 C.花生油 D.白酒
8.小明不小心向汤多加了食盐,汤变“咸”了,要使汤变“淡”,下列措施可行的是 ( )
A.继续加热 B.向汤加水 C.向汤加花生油 D.将汤减少一半
9.下列各组物质发生反应,生成物同时有“沉淀…‘气体…‘水”中的两种的是 ( )
A.Na2CO3溶液和CaCl2溶液 B.Ba(0H)2溶液和CuSO4溶液
C.稀硫酸和Ba(OH)2溶液 D.Fe2O3粉末和盐酸
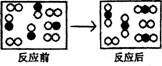 10.下图是某个化学反应前、后的微观模拟图。则实际参与反应的○●和○○两种粒子个数比为 ( )
10.下图是某个化学反应前、后的微观模拟图。则实际参与反应的○●和○○两种粒子个数比为 ( )
A.1:1 B.1:2 C.2:1 D.4:3
第Ⅱ卷(非选择题,共70分)
二、填空题(本题有3小题,共1 8分)
11.(6分)用化学符号填空:
(1)稀盐酸中的阳离子 ;(2)保持氧气化学性质的最小粒子 ;(3)+2价的钙元素 。
12.(4分)乙醇燃烧时放出大量的热,故它常用作燃料。
(1)请写出乙醇燃烧的化学方程式: ;
(2)与乙醇结构相似的化合物还有甲醇(CH3OH)、丙醇(C3H7OH)、丁醇(C4H9OH)……等,这类物质称为醇类,则含n个碳原子的醇的化学式为
13.(8分)某同学没计和进行了如下实验:
①将约0.4 g表面光亮的铁丝绒,绕成团,用水浸湿后,放进量筒中;
②将量筒倒置在装有蒸馏水的水槽中,并使量筒内的水面调至10.0 mL的刻度处,固定;
 ③当量筒内的水面不再上升时,停止实验。如图所示。请回答:
③当量筒内的水面不再上升时,停止实验。如图所示。请回答:
(1)铁丝绒表面的变化是: ;
(2)上述(1)变化的条件是: ;
(3)量筒内水面最后约在 mL刻度处(忽略铁丝体积和上升水柱压强的影响);
(4)如果你的自行车被雨淋湿后,你采取的防锈措施是:
三、简答题(本题有3小题,共20分)
14.(6分)乙烯(C2H4)是石油化工最重要的基础原料。我市乙烯生产能力由开始时年产三十万吨的规模,现正向100万吨的目标奋进,这将有力地推动我市的工业发展。从乙烯的化学式C2H4,你知道哪些信息?请写出三点(回答不要求。涉及相对原子质量):
(1)
(2) (3)
15.(6分)元旦晚会上,小东在表演节目:在一张白纸上喷上碘酒,“空白”的纸出现了“新年快乐”四个蓝色大字。原来小东是根据淀粉溶液遇到碘会变色的原理,表演前先用无色的米汤(含有淀粉)在白纸上写上“无色”的字,喷上碘酒后,字上的淀粉遇到碘变蓝色,字便可见了。同学们,请你不用小东的方法,也表演一个这样“白纸显字”节目:你用 写字,用 显字,字的颜色为 。
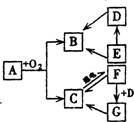 16.(8分)下图为A、B、C、D、E、F、G等物质的转化关系。已知A为天然气的主要成分,E为一种固体非金属单质,G为假酒的有毒成分----甲醇。
16.(8分)下图为A、B、C、D、E、F、G等物质的转化关系。已知A为天然气的主要成分,E为一种固体非金属单质,G为假酒的有毒成分----甲醇。
请你根据框图中物质的转化关系(部分反应条件已略去),回答下列问题:
(1)用化学式表示:A ;C 。
(2)用置换反应来实现E→B,反应的化学方程式为:
(3)F与D在高温和催化剂条件下反应得到G,反应的化学方程式为:
四、实验与探究题(本题有2小题。共20分) .
17.(10分)下列是实验室常用的装置:
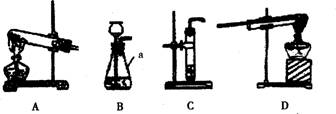
回答下列问题:
(1)图中仪器a的名称是 。
(2)A装置可用于实验室制取 (填气体名称)。
(3)实验室制取二氧化碳的发生装置可选用: :(填编号:
 (4)右图为某同学用一支废试管(底部有小破洞)和一些必要的仪器设计的二氧化碳气体发生装置。请回答:①利用该装置制取CO2时,如果要停止产生气体,如何操作呢?
。②对比你选择的制取CO2装置,你认为该装置的优点是:
(只需回答一点)。
(4)右图为某同学用一支废试管(底部有小破洞)和一些必要的仪器设计的二氧化碳气体发生装置。请回答:①利用该装置制取CO2时,如果要停止产生气体,如何操作呢?
。②对比你选择的制取CO2装置,你认为该装置的优点是:
(只需回答一点)。
18.(10分)学校化学兴趣小组知道二氧化锰能作过氧化氢分解的催化剂后,再想探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂。请你一起参与他们的探究过程,并填写下列空白。
(1)[问题]Al2O3能不能作过氧化氢分解的催化剂呢?
(2)[猜想]Al2O3能作过氧化氢分解的催化剂。
(3)[实验验证]
| 实验步骤 | 实验现象 | 实验结论 | |
| 实验一 | 木条不复燃 | 常温下过氧化氢溶液不分解 | |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 木条复燃 |
(4)[结论]Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂。
(5)[讨论与反思]经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验:
实验三:
[实验目的]探究
[实验步骤]①准确称量Al2O3(少量)的质量;②完成实验二;③待反应结束,将实验二试管里的物质进行过滤,洗涤, ,称量;④对比反应前后Al2O3的质量。
[讨论]如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂。
(6)但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验:探究 。
五、计算题(本题有1小题,共12分)
19.(12分)胃酸(主要成分是盐酸)过多,会引起很多胃病。某抗酸药的主要成分是氢氧化镁[Mg(OH)2]。请回答下列问题。
(1)氢氧化镁由 种元素组成,其组成元素(按化学式中元素的次序)的质量比(最简比)为 ;氢氧化镁中镁元素的质量分数为 (保留一位小数)。
(2)某同学为测定该药中氢氧化镁的质量分数进行如下几步操作:取一片药片(药片质量均为0.5 g),研碎后加20 mL蒸馏水,然后用质量分数为5%的盐酸进行反应(假设其他成分不与盐酸反应),测得实验中反应掉的盐酸质量为7.3 g。则该药片中氢氧化镁的质量分数为多少?
广东省茂名市化学答案
1.A 2.C 3.A 4.C 5.D 6.B 7.A 8.B 9.C 10.B
+2
11.(1)H+; (2)O2; (3)Ca
12.(1)C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
(2)CnH2n+l OH或CnH2n+2O
13.(1)表面生成红色铁锈
(2)铁与潮湿空气接触(或铁与氧气和水同时接触)
(3)7.9或8
(4)用布擦干,涂上油
14.(1)表示乙烯这种物质;
(2)表示1个乙烯分子;.
(3)表示乙烯由碳、氢两种元素组成;
(4)表示乙烯是一种有机物(化合物);
(5)表示1个乙烯分子由2个碳原子和4个氢原子构成。
15.①酚酞;氢氧化钠(或其他碱溶液);红色
②氢氧化钠(或其他碱溶液);酚酞;红色
③氢氧化钠(或其他碱溶液);石蕊试液;蓝色
④稀盐酸(或其他稀酸溶液);石蕊试液;红色
16.(1)CH4 H2O
(2)C+2CuO
![]() CO2↑+2Cu(或3C+2Fe2O3
CO2↑+2Cu(或3C+2Fe2O3 ![]() 3CO2↑+4Fe等
3CO2↑+4Fe等
(3)C0+2H2
![]() CH3OH
CH3OH
17.(1)锥形瓶
(2)氧气
(3)B或C
(4)①将试管提起,使之离开酸液即可(或夹紧胶管,使固体与酸液分离)。
②该实验设计用到的实验用品最少;或操作方法最简便(或可随时停止反应,控制CO2的量)。
18.(3)实验一:将带火星的木条伸入装有过氧化氢溶液的试管中
实验二:加入Al2O3,能加快过氧化氢溶液的分解速率
(5)Al2O3在反应前后质量是否改变;干燥
(6)Al2O3的化学性质在反应前后是否改变。
19.(1)3;12:16:1;41.4%
(2)药片中氢氧化镁的质量为O.29 g
药片中氢氧化镁的质量分数为:58%