![]()
 初三化学期中试卷(2006.11)
初三化学期中试卷(2006.11)
(满分:100分,时间:100分钟)
友情提醒:树立信心,细心谨慎,志在必胜!
相对原子质量 O:16 C:12 Ca:40 H:1 N:14 Cl:35.5 Mg:24
一、我会选(每小题只有一个正确答案,每小题2分,共30分)
( )1. 下列都是生活中常见的物质,其中属于纯净物的是
A.黄酒 B.冰水 C.碘盐 D.食醋
( )2.实验室中装有浓硫酸的试剂瓶应贴有的图标是

A B C D
( )3.天文学家观察到“百武”彗星因受到越来越强的阳光照射而产生喷气现象。喷出气体包括:CO、CH3OH(甲醇)、HCHO(甲醛)、HCN(氢氰酸)等有毒物质和水蒸气。根据这一信息可以推测:
A.“百武”彗星至少含有C、H、N、O元素
B.“百武”彗星中存在单质和化合物
C.“百武”彗星是一个液态混合物
D.“百武”彗星可能存在生命
( )4.下列叙述不适合用质量守恒定律解释的是
A.水加热变成水蒸气,变化前后质量相等
B.要得到18g水,则参加反应的氢气和氧气的总质量一定为18g
C.1g硫与1g氧气化合生成2g二氧化硫
D.在置换反应中,参加反应的单质的质量不一定等于生成的单质质量
( )5.已知纳米材料是指粒子直径在1~100nm的材料。美国IBM 制造出了第一批纳米碳管晶体管,发明了利用电子的波性为传递信息的“导线”。下列有关纳米碳管的说法正确的是
A、纳米碳管是一种新型的高分子化合物 B、纳米碳管的化学性质活泼
C、纳米碳管导电属于化学变化
D、纳米碳管、金刚石、石墨、C60的构成相同
( )6..R元素在化合物中只有一种化合价“+3”价,则下列化学方程式中错误的是
A.2R+3H2SO4=R2(SO4)3+3H2↑
B.4R+3O2![]() 2R2O3
2R2O3
C.R+2HCl=RCl2+H2↑ D.2R+6HCl=2RCl3+3H2↑
( )7. 某化合物[R]在空气中燃烧的化学方程式是:2[R]+3O2===2CO2+4H2O,则化合物[R]的化学式为
A.CH4 B.C2H4 C.CH3OH D.C2H5OH
( )8.如下图所示,两个甲分子反应生成三个乙分子和一个丙分子,则从图示获得的信息中,不正确的是

A.分子的种类在化学反应中发生了改变
B.该反应的反应类型为分解反应
C.反应生成的丙物质属于单质
D.乙分子中含有一个A原子,一个B原子
( )9..有A和B两种物质,在一定条件下反应生成C和D,已知2g A能跟5g B恰好完全反应生成4g C和3g D,现有6g A和20g B,经充分反应后,下列说法中正确的是
A.生成C和D的质量之和为26g B.生成12gC
C.有1g A剩余 D.生成10g D
( )10..镁在空气中燃烧时,发生如下两个反应:3Mg+N2![]() Mg3N2 2Mg+O2
Mg3N2 2Mg+O2![]() 2MgO已知24g镁在纯氧中完全燃烧可得40g产物,那么24g镁在空气中完全燃烧所得产物的质量
2MgO已知24g镁在纯氧中完全燃烧可得40g产物,那么24g镁在空气中完全燃烧所得产物的质量
A.等于40g B.小于40g C.大于40g D.无法确定
( )11.在盛放石灰水的试剂瓶的内壁,常附有一层白色固体物质,要想将它清除,应采用的方法是
A.用蒸馏水洗涤 B.用稀盐酸洗涤 C.用稀硫酸洗涤 D.用石灰水洗涤
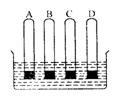 ( )12.如右图所示,若同时拔开橡胶塞,试管内的水位线上升最高的是
( )12.如右图所示,若同时拔开橡胶塞,试管内的水位线上升最高的是
A.充满氢气的A试管 B.充满氧气的B试管
C.充满一氧化碳的C试管 D.充满二氧化碳的D试管
( )13.用I2O5可以测定空气受CO污染的程度,发生反应的化学方程式如下:I2O5+ 5CO==== I2+ 5CO2,根据生成CO2的多少,可以判定CO的含量,关于这个反应,下列说法正确的是:
A. 参加反应的I2O5的质量等于生成I2的质量
B. 参加反应的各物质中的氧原子总数等于生成的CO2中氧原子的总数
C. 参加反应的I2O5和CO的质量比等于生成I2和CO2的质量比
D. 反应物所含元素种类与生成物所含元素种类不同
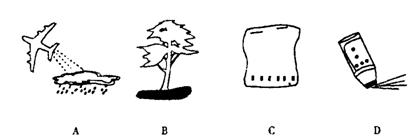
( )14.下列图示是二氧化碳的几种用途,其中既利用了它的物理性质,又利用了它的化学性质的是
![]()
( )15. 在CO和CO2的混合气体中,氧元素的质量分数为64%。将该混合气体5g通过足量的灼热的氧化铜,充分反应后,气体再全部通入足量的澄清石灰水中,得到的白色沉淀的质量是
A.5 g B.10g C.15g D.20g
二、我会选(每题有1~2个答案,每题2分,共10分)
( )16.在下列物质的变化中,不能用质量守恒定律解释的是
A.煤燃烧后剩余煤渣的质量小于煤的质量
B.伐倒的树木放置一段时间后质量减少
C.铁生锈以后总质量比原来铁的质量大
D.水结成冰以后,冰的质量与水的质量相等
( )17.已知由同种元素组成的不同种单质互称为同素异形体,下列各组物质互为同素异形体的是
A.液氢 氢气 B.金刚石 石墨 C.氧气 臭氧(O3) D.SO2 SO3
( )18.现有四组气体:①氮气和二氧化碳,②氧气和二氧化碳,③氢气和二氧化碳,④空气和二氧化碳。可用同一试剂加以区别,这种试剂是
A.燃着的木条 B.紫色石蕊试液 C.澄清石灰水 D.带火星的木条
( )19. .超临界CO2流体是一种与水相似、能阻燃、溶解能力强的溶剂,被誉为“绿色环保溶剂”。下列有关它的说法错误的是
A.它作为“绿色环保溶剂”能代替许多有害、有毒、易燃的有机溶剂
B.超临界CO2流体是一种特殊的物质,带火星的木条可以在其中复燃
C.CO2是自然界中存在的物质,它参与自然界的碳元素循环
D.超临界CO2流体与固体干冰的组成相同
( )20. .木炭、一氧化碳在一定条件下都能与CuO发生反应,下列叙述正确的是
A.反应中C、CO都得到氧,发生氧化反应
B.反应前后C、Cu、O三种元素的化合价都发生了变化
C.反应都必须在加入或高温的条件下才能进行
D.反应导出的气体都有毒,需进行处理以防止空气污染
三、我会填(共27分)
21. (8分)化学用语
(1)2个氢分子_____ 5个亚铁离子______ ;氩气______ ;
(2) 氧化铜中铜的化合价为十2价_____________________ ;
(3)H2O中2的意义_______________________
(4)有还原性的气体化合物 (5)可用作致冷剂的物质是
(6)汽水中含有一种酸为
22. (2分)某化学兴趣小组的同学在老师的指导下,用炉甘石(主要成分为ZnCO3)、赤铜(Cu2O)与木炭粉(C)混合加热到880℃,得到了多种物质,在锌、铜、金、二氧化碳中,你认为不可能得到的是(写化学式) ,理由是
23.(4分)为了保证长时间潜航,在潜水艇里需配备氧气发生装置,有以下几种制取氧气的方法:①加热高锰酸钾;②电解水;③在常温下用过氧化钠固体(Na2O2)与二氧化碳反应生成碳酸钠固体和氧气。
(1)写出方法③反应的化学方程式: 。
(2)你认为最适合在潜水艇里制取氧气的方法是(填序号) ;与其它两种方法比较,这种方法的两条优点是 。
24.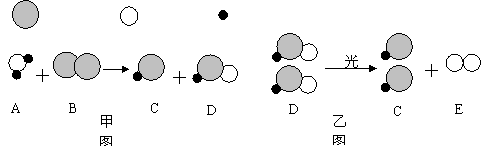 (6分)自来水消毒过程中通常会发生如下化学反应,其反应的微观过程可用下图表示:
(6分)自来水消毒过程中通常会发生如下化学反应,其反应的微观过程可用下图表示:
( 表示氯原子, 表示氧原子, 表示氢原子)
![]()

⑴请写出甲图所示反应的化学方程式 ;
⑵乙图所示反应的基本反应类型为 ;
⑶上述物质中,属于单质的有 (填化学式);
⑷D物质中氯元素的化合价为 ;
⑸以甲图为例分析,你能总结出的一条结论是 。
25.(3分)在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:![]() 反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。
反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。
(1)根据化合价是否变化分析下列反应属于氧化还原反应的是(填序号) 。
A.2Mg+O2![]() 2MgO B.CaO+H2O=Ca(OH)2
2MgO B.CaO+H2O=Ca(OH)2
C.2KClO3![]() 2KCl+3O2↑ D.CaCO3
2KCl+3O2↑ D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
E.H2+CuO![]() Cu+H2O F.HCl+NaOH=NaCl+H2O (2)根据上面的分析推理,对下列两种基本反应类型是否属于氧化还原反应,作出恰当的概括。
Cu+H2O F.HCl+NaOH=NaCl+H2O (2)根据上面的分析推理,对下列两种基本反应类型是否属于氧化还原反应,作出恰当的概括。
化合反应: 。
分解反应: 。
26.(4分)(9分)一氧化氮是大气的主要污染物之一。近几年来,又发现在生物体内存在少量的一氧化氮,它有扩张血管和增强记忆力的功能,成为当前生命科学研究的热点。
|
4X+5O2 ![]() 4NO+6H2O,根据质量守恒定律推断,X的化学式为
。
4NO+6H2O,根据质量守恒定律推断,X的化学式为
。
⑵汽车尾气中含有一氧化氮、一氧化碳等有毒气体,治理的方法是在汽车尾气的排风管上装一个催化转换器,在催化剂的作用下,一氧化氮与一氧化碳反应可生成二氧化碳和氮气,该反应的化学方程式为: 。
⑶某同学希望了解尾气中一氧化碳的含量,于是在环保科研人员的帮助下,采集了一定量的汽车尾气,并把它转化为二氧化碳和氮气。下面该同学该怎样将二氧化碳和氮气分开呢?并设法计算出一氧化碳的含量 。
四、我会实验,探究(共20分)
27.(3分)下列实验技能都是你必须具备的,你能作出正确回答吗?
⑴如何判断玻璃仪器已经洗涤干净?
。
⑵加热氯酸钾制氧气,用排水法收集,何时开始?
。
⑶洒出的酒精在桌上燃烧起来,如何处理?
。
28. (6分) 阅读下面小文章,回答问题。
氢气在通常状况下,是一种无色无味、难溶于水、在相同条件下密度最小的气体。它在空气中能安静的燃烧,产生淡蓝色的火焰。氢气常在实验室被使用,如它能和氧化铜反应,将氧化铜还原成铜,并生成水。氢气被人们所喜爱,因为它有着很多优点。如资源丰富(以水为原料制取)、燃烧产物是水(无污染)、燃烧放出热量多等等。
⑴ 试想,如果在实验室制取氢气,应用什么方法收集?
⑵ 写出所有文中出现的反应的化学方程式。
⑶ 根据文中信息,写出利用氢气物理性质和化学性质的用途各一条。
29 . (11分)比较与归纳,是我们学习化学的常用方法。请结合下列实验常用装置,回答有关问题。
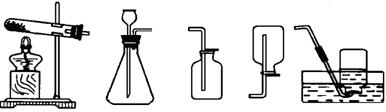
A B C D E
(1)用A和E组合装置制取氧气,发生反应的化学方程式为________________________________________________,
将药品加入装置A中的试管前,应进行的操作是______________________________________。
(2)实验室制取二氧化碳气体应选用的发生装置和收集装置分别为_____________,用该发生装置制取气体应满足的一般条件是 。实验室制取大量CO2气体,是否能用稀硫酸和大理石为原料? (填“是”或“否”)为什么? 。
甲图是实验室制备CO2的装置图。该装置的特点是:打开弹簧夹,大理石和盐酸接触,发生反应;关闭弹簧夹后,盐酸被反应产生的CO2气体压回长颈漏斗,与大理石分离,停上反应。用该装置制备CO2可起到节约药品和取用方便的效果。A、B、C、D装置中哪些可以起到与甲图装置相同的效果? (填写编号)。
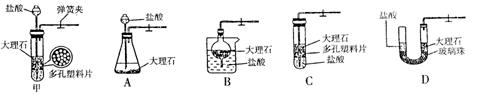
(3)若用A装置进行木炭还原氧化铜实验并检验气体产物,还需补充部分装置。补充装置中所需的仪器是______________________________,所需的化学药品为 。发生反应的化学方程式为___________________________,_________________________________。
六、我会计算(共14分)
30. (7分) 某课外活动小组为测定当地石灰石中含碳酸钙的质量分数,取来了一些矿石,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 5 | 10 | 15 | 20 |
| 生成CO2的质量/g | 1.54 | 3.08 | 4.4 | m |
⑴哪几项反应中盐酸有剩余______________;⑵ m= __________________;
⑶试计算这种石灰石矿中碳酸钙的质量分数。
31 (6分)中国是一个人口众多的发展中国家,人们注意到:西方国家的发展模式不完全适用于中国,例如:
(1)设想中国每家都有轿车,则每天需供应8000万桶石油(目前全世界每天的产油量约为6700万桶),如果每7桶石油为1吨,每吨石油能提炼出70%(质量分数)的燃料油,以燃料油中平均含C、H原子比例为10∶22(燃烧产物为二氧化碳、水)计算,到那时,中国由于轿车燃油将可能每天排放温室气体多少万吨?
(2)设想以植物性食物为主的中国人,平均食用牛肉的水平若与美国人相当,则每年需增加粮食3.4亿吨(这相当于美国一年的粮食产量),如果每吨粮食生产需提供0.1吨氮元素,则:
①中国每年将需要多供应多少吨尿素[CO(NH2)2]?
②尿素生产原理为:![]() ,据此计算:为增产尿素,需再建年产20万吨合成氨的工厂几座?
,据此计算:为增产尿素,需再建年产20万吨合成氨的工厂几座?
参考答案
选择 BAAAD CCDBB DBBDC BD BC BC B A
21. 2H2 5Fe2+ Ar CuO 一个水分子中有2个氢原子 CO;CO2 ; H2CO3
22. Au,化学反应前后元素的种类不变。
23.(1)2Na2O2+2CO2=2Na2CO3+O2
(2)③;优点是:①不消耗能源;②利用了人呼出的二氧化碳,将其转化为氧气。
24.⑴H2O+Cl2=HCl+HClO
⑵分解反应
⑶Cl2 (1分)、O2 (1分)
⑷+1
⑸化学反应前后原子的种类、数目不变(或化学反应前后元素的种类不变、化学反应的本质是原子的重新组合等合理说法均给分)(1分)
25.(1)A、C、E;
(2)化合反应:有单质参加的化合反应是氧化还原反应;分解反应:有单质生成的分解反应是氧化还原反应。
26.⑴NH3 ;⑵2CO+2NO![]() 2CO2+N2;⑶将产生的气体通过盛有澄清石灰水的洗气瓶,并称量实验前后洗气瓶及瓶内物质的质量,二者的差值为二氧化碳的质量,再根据该质量计算出参加反应的一氧化碳的质量,然后与尾气总量相比,求得一氧化碳的含量。
2CO2+N2;⑶将产生的气体通过盛有澄清石灰水的洗气瓶,并称量实验前后洗气瓶及瓶内物质的质量,二者的差值为二氧化碳的质量,再根据该质量计算出参加反应的一氧化碳的质量,然后与尾气总量相比,求得一氧化碳的含量。
27.⑴仪器内壁附着的水既不聚成水滴,也不成股流下
⑵当气泡连续并均匀地放出时,开始收集
⑶立即用湿抹布扑盖
28.⑴ 排水法或向下排空气法(均写得2分)
![]()
|
⑶ 本题属开放题,回答合理即给分,但必须是物性和化性各一。
![]() 29. (1) (1) 2KMnO4 K2MnO4 + MnO2
+O2↑ 检查气密性
29. (1) (1) 2KMnO4 K2MnO4 + MnO2
+O2↑ 检查气密性
(2) B D 反应物为固体与液体或液体与液体,不需要加热
①否 因为大理石与稀硫酸反应生成微溶的硫酸钙覆盖在大理石表面,阻止了硫酸与大理石的进一步反应。 ②BD
(3) 导管、试管或烧杯 澄清石灰水 C+2CuO![]() 2Cu+CO2↑Ca(OH)2+CO2===CaCO3↓+H2O
2Cu+CO2↑Ca(OH)2+CO2===CaCO3↓+H2O
30.(1)3、4 (2)4.4g
(3)解:设这种石灰石矿中碳酸钙的质量分数为x
CaCO3 + 2HCl ==== CaCl2 + H2O + CO2↑
100 44
5g×x 1.54g
100 44
5x g 1.54g
x=70%
答:该这种石灰石矿中碳酸钙的质量分数为70%.
31. (1) 2478.9万吨 (2)7300万吨 (3)207座