化 学 试 卷 三
可能用到的原子量:H—1 C—12 O—16 S—32 Na—23 Cl—35.5
Ca—40 Mg—24 Cu—64 Zn—56
一、选择题:
在每小题列出的四个选项中只有一项符合题目要求。
1.下列现象中,属于化学变化的是
(A) 玻璃破裂 (B) 车胎漏气
(C) 煤气燃烧 (D) 空气液化
( )
2. 下列物质中,属于氧化物的是
(A) Na2SO3 (B) SiO2
(C) HClO (D) KMnO4
( )
3.下列物质中,属于纯净物的是
(A) 洁净的空气 (B) 澄清的石灰水
(C) 无色的汽水 (D) 蓝色的胆矾
( )
4.下列分子式中,书写正确的是
(A) CaHCO3 (B) Cu(OH)2CO3
(C) NaSO4 (D) Al2O3
( )
5.下列过程中,不能产生二氧化碳的是
(A) 植物的光合作用 (B) 呼吸
(C) 木炭燃烧 (D) 煅烧石灰石
( )
6.下列物质中,跟酸、碱、盐都能起反应的是
(A) 氧化钙 (B) 碳酸钠
(C) 稀硫酸 (D) 氢氧化钠
( )
7.“2O”表示的化学意义正确的是
(A) 两个氧分子 (B) 两种氧元素
(C) 两个氧原子 (D) 氧气
( )
8.下列物质中,锰元素化合价最高的是
(A) MnO2 (B) MnCl2
(C) KMnO4 (D) K2MnO4
( )
9. 用铁矿石(主要成分是Fe2O3)炼铁,CO是
(A) 燃料 (B) 还原剂
(C) 氧化剂 (D) 催化剂
( )
10. 能正确表示铁跟盐酸反应的化学方程式是
(A) 2Fe+6HCl=2FeCl3+3H2↑
(B) Fe+HCl=FeCl2+H2↑
(C) Fe+2HCl=FeCl2+2H↑
(D) Fe+2HCl=FeCl2+H2↑
( )
11. 向20%的烧碱溶液中,再加入3克固体烧碱和12克水,所得溶液的百分比浓度是
(A) 25% (B) 23%
(C) 20.5% (D) 20%
( )
12. 下列实验操作中,正确的是
(A) 用酒精灯的外焰给试管加热
(B) 用剩的药品立即放回原试制瓶
(C) 把称量物放在托盘天平右盘上称量
(D) 在量筒里配制一定百分比浓度的溶液
( )
13.下列物质中,不能用来鉴别CO和CO2的是
(A) 澄清石灰水
(B) 蒸馏水
(C) 灼热的氧化铜
(D) 紫色的石蕊试剂
( )
14. 下列各组微粒中,最外层都具有稳定电子层结构的是
(A) Ne和Mg (B)
O和O![]() -
-
(C) Ar和S![]() - (D) Na和Si
- (D) Na和Si
( )
15. 用浓度和质量都相同的两份盐酸分别与足量的碳酸钙和碳酸镁反应,则生成二氧化
碳的质量正确的是
(A) 相等 (B) 碳酸钙的多
(C) 碳酸镁的多 (D) 无法比较
( )
二、填空题:
16. 水由( )元素和O元素按质量比( )组成。每个水分子是由( )和( )构成的。水在直流电的作用下可分解成氢气和氧气。
17.中性溶液的pH值增大,碱性增强;pH值减少,酸性增强。把三氧化硫、氧化钠和氯化钠分别溶于水后,再各滴入紫色石蕊试液。
(1) ( )溶于水所形成的溶液pH值>7,石蕊试液显蓝色。
(2)SO3溶于水所形成的溶液pH值<7,石蕊试液显( )。
(3) ( )溶于水所形成的溶液pH值=7,石蕊试液显紫色。
18.某物质在20℃时的溶解度为25克,若在20℃时该物质25克放入75克水中充分溶解,
则所得溶液的百分比浓度是( )
19.有三种金属A、B、C。已知A能从C盐溶液中置换出金属C,B能从A盐溶液中置换出金属A,则这三种金属的活动性由强到弱的顺序为( )
20.当一氧化碳和二氧化碳的质量比为( )时,这两种物质分子里的氧原子数目相等。
21.除去CO中混有的少量CO2可将混和气体通入过量的( )溶液中。(填分子式)
22.某化合物的分子式为HnROn+2,其中R的化合价可表示( )。当R的化合价为+6时,该化合物在水溶液中的阴离子可表示为( ![]() )。
)。
三、判断题:
23.用熟石灰和硫酸铜来配制农药波尔多液时,不能使用铁制容器,共原因是(用化学
方程式表示)( Fe+CuSO4=FeSO4+Cu)。
( )
24.用一种试剂就能鉴别出氢氧化钙、氢氧化钠和稀硫酸三种无色溶液,该试剂是( Na2CO3 )溶液。
( )
25. 用化学方程式表示下列反应,并注明所属基本反应类型。
(1) 硝酸银溶液跟盐酸混和
( AgNO3+HCl=AgCl↓+HNO3 )是( 复分解 )反应。
( )
(2) 一氧化碳燃烧
( 2CO+O2 ![]() 2CO2 )是( 化合 )反应。
2CO2 )是( 化合 )反应。
( )
(3) 锌片插入硫酸铜溶液
( Zn+CuSO4=ZnSO4+Cu )是( 置换 )反应。
( )
(4) 加热氢氧化铁
( 2Fe(OH)3![]() Fe2O3+3H2
)是( 分解 )反应。
Fe2O3+3H2
)是( 分解 )反应。
( )
26. 现有硝酸、氢氧化钾和碳酸钠三种物质。
(1)写出三种物质的电离方程式。
硝酸( HNO3=H![]() +
+![]() )
)
( )
氢氧化钾( KOH=K![]() +OH
+OH![]() )
)
( )
碳酸钠( Na2CO3=2Na![]() +
+![]() )
)
( )
(2) 写出将三种物质的溶液两两混和后所发生的化学方程式。
( HNO3+KOH=KNO3+H2O )
( 2HNO3+Na2CO3=2NaNO3+H2O+CO2↑)
( )
四、计算题:
27. 已知30℃时,氯酸钾的溶解度是10克。把30℃时配制的44克氯酸钾饱和溶液蒸干后
,可得到氯酸钾多少克?
(A) 2克 (B) 3克 (C) 4克 (D) 5克
( )
解:设可得到氯酸钾x克。
(100+10)∶10=44∶x
![]() (克)
(克)
28. 把锌和铜的混和物50克与足量的稀硫酸反应,可制得1.2克氢气,求混和物中铜的
百分含量。
(A) 21% (B) 22% (C) 23% (D) 24%
( )
解:设混和物中有x克锌。
Zn+H2SO4=ZnSO4+H2↑
65 2
x克 1.2克
65∶2=x∶1.2![]() 克
克
则混和物中铜的百分含量为![]()
可能用到的原子量:H—1 C—12 O—16 Na—23 Mg—24 S—32
K—39 Cl—35.5 N—14 Ag—108
五、选择题:在每小题列出的四个选项中只有一项符合题目要求。
29. 关于N2、N2O、N2O5的叙述,正确的是
(A) 都含有氮气的分子
(B) 在1个分子中氮的原子数相数
(C) 组成元素的种类相同
(D) 氮元素的百分含量相同
( )
30. 能区别H2和CO的方法是
(A) 观察火焰的颜色
(B) 通过灼热的氧化铜
(C) 闻气味
(D) 通入石灰水中
( )
31. 下列各组气体中,可以用同一种方法收集的是
(A) H2、O2、CO (B) CO、CH4、CO2
(C) H2、CH4、CO2 (D) CO、H2、CO2
( )
32. 同种元素的原子和离子,一定具有相同的
(A) 质子数
(B) 核外电子数
(C) 电子层数
(D) 最外层电子数
( )
33. 现有8%的食盐水40克,要使它的浓度达到20%,可采用的方法是
(A) 加入4.8克食盐
(B) 蒸发20克水
(C) 蒸发24克水
(D) 加入40克20%的食盐水
( )
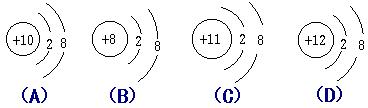 |
34. 下列微粒的结构示意图中,表示阴离子的是
( )
35. 能证明生石灰中含有碳酸钙的最简便方法是
(A) 高温加热
(B) 加水后通入CO2
(C) 滴入碳酸钠溶液
(D) 滴入稀盐酸
( )
36. 酸、碱、盐三类物质的共同点是
(A) 都是电解质 (B) 都含有氧元素
(C) 都含有酸根 (D) 都能溶于水
( )
37. 现有浓硫酸和浓盐酸两瓶溶液,敞口放置一段时间后(假充水分未蒸发),则两溶液
的变化正确的是
(A) 质量都变小 (B) 体积都变小
(C) 浓度都变小 (D) 浓度都变大
( )
38. 下列各组物质的溶液,两两混和都能发生反应的一组是
(A) BaCl2、NaCl、Na2SO4
(B) AgNO3、HCl、Cu(NO3)2
(C) Ca(OH)2、K2CO3、HCl
(D) NaOH、H2SO4、Ba(NO3)2
( )
六、计算题:
39. 在29.4克未知浓度的稀硫酸中加入0.8克固体烧碱,中和后的溶液仍显酸性。再
向溶液中加入1.5克镁,充分反应后有0.3克镁剩余。求硫酸溶液的百分比浓度。
(A) 20% (B) 21% (C) 22% (D) 23%
( )
解:设与镁反应的硫酸为x克。
Mg+H2SO4=MgSO4+H2↑
24 98
1.5-0.3 x克
=1.2(克)
24∶98=1.2∶x x=4.9(克)
设与0.8克NaOH中和的硫到为y克。
2NaOH+H2SO4=Na2SO4+2H2O
80 98
0.8克 y克
80∶0.8=98∶y y=0.98(克)
则稀硫酸的百分比浓度为
![]()
答:硫酸溶液的浓度为20%。
40. 现有氯酸钾和氯化钾的混和物197克,在一定条件下,加热该混和物至不再有气体产生后,将剩余的固体物质溶于水再与足量硝酸银溶液反应,得白色沉淀287克。求原混和物中氯酸钾和氯化钾各多少克?
(A) 121.5克;74.5克 (B) 122.5克;71.5克
(C) 122.5克;74.5克 (D) 122.5克;73.5克
( )
解:设反应剩余物中有氯化钾x克。
KCl+AgNO3=AgCl↓+KNO3
74.5 143.5
x克 287克
74.5∶x=143.5∶287 x=149(克)
设原混和物中有氯酸钾y克,则有氯化钾(197-y)克。
2KClO3=2KCl+3O2↑
245 149
y克 149-(197-y)
=y-48(克)
245∶y=149∶(y-48) y=122.5(克)
则原混和物中含氯化钾质量为 197-122.5=74.5(克)
答:原混和物中含氯酸钾122.5克,氯化钾74.5克。
参 考 答 案
一、1. C 2. B 3. D 4. D 5. A 6. B 7. C
8. C 9. B 10. D 11. D 12. A 13. B 14. C 15. A
二、
16. ( H ) ( 1∶8 ) ( 2个氢原子 ) ( 1个氧原子 )
17. (1)( NaO ) (2)( 红色 ) (3)( NaCl )
18.( 20% ) 19.( BAC ) 20.( 14:11)
21.( KOH ) 22.( +(n+4) )
三、23.对 24.对 25. (1)对 (2) 对 (3) 对 (4) 对
26. (1) 对;对;对 (2) 对
四、27. C
解:设可得到氯酸钾x克。
(100+10)∶10=44∶x
![]() (克)
(克)
28. B
解:设混和物中有x克锌。
Zn+H2SO4=ZnSO4+H2↑
65 2
x克 1.2克
65∶2=x∶1.2![]() 克
克
则混和物中铜的百分含量为![]()
五、29. B 30. B 31. A 32. A 33. C
34. B 35. D 36. A 37. C 38. C
六、39. A
解:设与镁反应的硫酸为x克。
Mg+H2SO4=MgSO4+H2↑
24 98
1.5-0.3 x克
=1.2(克)
24∶98=1.2∶x x=4.9(克)
设与0.8克NaOH中和的硫到为y克。
2NaOH+H2SO4=Na2SO4+2H2O
80 98
0.8克 y克
80∶0.8=98∶y y=0.98(克)
则稀硫酸的百分比浓度为
![]()
答:硫酸溶液的浓度为20%。
40. C
解:设反应剩余物中有氯化钾x克。
KCl+AgNO3=AgCl↓+KNO3
74.5 143.5
x克 287克
74.5∶x=143.5∶287 x=149(克)
设原混和物中有氯酸钾y克,则有氯化钾(197-y)克。
2KClO3=2KCl+3O2↑
245 149
y克 149-(197-y)
=y-48(克)
245∶y=149∶(y-48) y=122.5(克)
则原混和物中含氯化钾质量为 197-122.5=74.5(克)
答:原混和物中含氯酸钾122.5克,氯化钾74.5克。