九年级科学保送生模拟试题(科学部分)
一、选择题(每小题仅1 个选项符合题意,本题包括16个小题,每小题2 分, 共32分。)
1. 已知某两种物质在光照条件下能发生化学反应,其微观示意图如下,则下列说法中正确的是( )
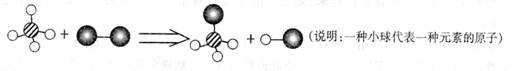
A. 图示中的反应物都是单质 B.该反应属于化合反应 C. 图示中共有4 种物质 D.该反应属于置换反应
2.下列关于生物多样性面临威胁的原因叙述中,哪一项不正确?
A. 毁林开垦、水土流失、环境恶化等原因造成森林面积锐减
B. 火山爆发、地震濒发、瘟疫流行等自然灾害是造成我国生物多样性锐减的重要原因
C. 人类对动植物资源的滥捕、乱伐及不合理的开发利用,造成大量物种濒临灭绝
D. 人类活动缺乏环保意识,造成生物生存环境的严重破坏
3. 图表资料可以为我们提供很多信息。下面是某学生对图表资料的使用,其中不正确的是
A. 根据溶解度曲线图,判断从溶液中获得晶体的方法
B. 根据金属活动性顺序表,判断金属能否能换出稀硫酸中的氢
C. 根据酸、碱、盐的溶解性表,判断某些复分解反应能否进行
D. 根据密度数据表判断液体物质挥发性的大小
4. 据气象台预报,某台风中心的移动路径如下表,则台风中心的前进方向是
| 时间 | 8 | 12 | 20 | 24 |
| 台风所处位置 | 114°E、21°N | 115°E、22.5°N | 117°E、23°N | 118°E、24°N |
A. 由西南向东北 B. 由东北向西南 C. 由东北转向西北 D. 由西北向东南
 5.如下图所示,R。的阻值和各电表的读数是已知的,Rx是待测电阻,图中不能测出Rx的值的电路是
5.如下图所示,R。的阻值和各电表的读数是已知的,Rx是待测电阻,图中不能测出Rx的值的电路是
6.一只量程为100ml的量筒,竖直放在水平桌面上,l00lml刻度线以上还可以容15ml的水,现给量筒盛水100ml,将一物块轻轻放入水中,从量筒中溢出25ml的水,物块没有触及量筒的底部和侧壁(g=1ON/kg) ,则物块的密度和重力 ( )
A.可能等于1×l03kg/m3,0.4N B. 可能等于1×l03kg/m3,0.25N
C.肯定等于1×l03kg/m3,0.4N D. 肯定等于1×l03kg/m3,0.25N
7.人的体温是由“下丘脑”中特殊神经细胞控制的,它对人体体温的变化很敏感。脑温度高于37℃时,人体散热机制(如血管舒张,出汗等)就会活跃起来。 已知37℃时蒸发18g 汗水所需要的能量为 4300J。某同学步行时,每秒钟体内产生的热量为35J,而此时该同学通过对流、辐射等方式(不包括出汗)产生的散热功率只有33W。 因此还要通过出汗的方式才能保持37℃的体温不变。 那么该同学步行1h 出汗约
A. 20g B. 30g C.40g D. 50g
8.研究物质的变化时可使用具有放射性的18O作为“示踪原子”,科学家希尔和尼尔研究证明,光合作用的通式应更合理地表达为: 6C02+12H2180![]() C6H1206+6H20+61802
C6H1206+6H20+61802
在光照充分的环境里,将一种植物黑藻放入含有“示踪原子”18O的水中,一段时间后,分析“示踪原子”,最有可能是
A.在植物体的周围的空气中发现 B.在植物体内的葡葡糖(C6H1206)中发现
C.在植物体内的淀粉和蛋白质中发现 D.无法确定示踪原子在什么地方出现
9.亚硝酸钠(NaNO2) 的外观与食盐很相似,有咸味,误食易中毒。 区别它们的一种方法是:将两者分别加热到 320℃ ,不分解的是食盐,能分解并放出一种具有刺激性气味气体的是亚硝酸钠。该气体可能是
A.NH3 B.SO2 C.NO2 D.N2
10.对分布于甲、乙、丙三地区的某种哺乳动物的平均测量结果如下表。如果测量数据来自长白山、武夷山、海南岛,那么以测量结果可以推测甲、乙、丙地区分别是
| 甲地 | 乙地 | 丙地 | |
| 身体 | 395 | 460 | 540 |
| 耳部 | 125 | 108 | 80 |
| 尾部 | 115 | 90 | 80 |
A.长白山、武夷山、海南岛 B.海南岛、武夷山、长白山
C.长白山、海南岛、武夷山 D.海南岛、长白山、武夷山
21.如图所示,形发光物经透镜L 在毛玻璃光屏上成一
 实像,观察者处于E
处,他看到光屏上的像的形状为
实像,观察者处于E
处,他看到光屏上的像的形状为

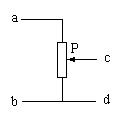
12.如下左图所示,这一天在北半球上可能是 ( )
A.春分 B.秋分 C.夏至 D.冬至
 |
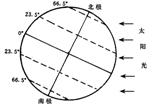
13.如上右图所示电路,P位于滑动变阻器的中点,当在ab之间加上60V的电压时,接在cd之间的电压表示数为30V,如果在cd之间加上60V的电压,将同样的电压表接在ab之间时的示数为 ( )
A.20V B.30V C.60V D.120V
14.在化学反应aZn+bHNO3(稀) = cZn(NO3)2+dNO↑+eH2O中,若e的值为4,则d的值为
( )
A.1 B. 2 C. 3 D. 4
15.如下图所示,一只弹簧测力计放在光滑的水平面上,弹簧测力计外壳质量不能忽略,弹簧及挂钩质量不计,现对弹簧测力计施加水平方向的力F1、F2,且F1>F2,则 ( )
A.弹簧测力计向左运动,读数为F2 B.弹簧测力计向左运动,读数为 F1
C.弹簧测力计向右运动,读数为F2 D.弹簧测力计向左运动,读数为F1和F2之间的某一数值
16.有五种生物(K、L、M、N、及E),它们属于同一科同一属,下表表示的是它们在六个显著特征方面的情况(“+”表示该物种具有该特征,“–”表示该物种不具有该特征)。
| 物种 | 特征 | |||||
| 1 | 2 | 3 | 4 | 5 | 6 | |
| K | + | – | + | + | + | – |
| L | – | – | – | – | + | – |
| M | + | – | – | – | – | – |
| N | – | + | – | – | – | – |
| E | + | – | + | + | – | – |
根据进化理论,物种最可能的进化路径是特征改变数量最少的那一条。如果是这样的话,物种E最可能的祖先是 ( )
A.K B. L C. M D. N
二、非选择题(共43分。)
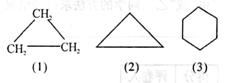 17.(2 分)在有机化学以碳、氢两种元素组成的环状化合物中,从含三个碳原子到含十个碳原子的碳、氢化合物都按丙、丁、戊、
已、庚、辛、壬、癸来标记碳原子数,并根据碳原子数命名为“环某烷”,如环丙烷,其化学式为C3H6,结构式如右图(1)
,也可简写为右图(2)。 现有一种由碳、氢两种元素组成的有机环状化合物,其结
17.(2 分)在有机化学以碳、氢两种元素组成的环状化合物中,从含三个碳原子到含十个碳原子的碳、氢化合物都按丙、丁、戊、
已、庚、辛、壬、癸来标记碳原子数,并根据碳原子数命名为“环某烷”,如环丙烷,其化学式为C3H6,结构式如右图(1)
,也可简写为右图(2)。 现有一种由碳、氢两种元素组成的有机环状化合物,其结
式简写成右图(3) ,该物质的名称是 ,化学式是 。
18.(8 分)维生素C又名抗坏血酸,易溶于水,能与碘反应,它是人体不可缺乏的有机物,化学式是 C6H806 。
(1)取2 片维生素C轻轻捣碎,放人一支大试管中,注入20ml 蒸馏水,振荡。用滴管吸取少量上层清液,滴在pH试纸上,测定溶液的pH =2。所以该溶液显 性(选填“酸”或“碱”) ,在 性(选填(选填“酸”或“碱”)环境中,维生素C易被破坏。
(2)烹调蔬菜前最好不用水浸,不捣碎、切薄,烹调时不要高温煸炒。 食用凉拌蔬菜或生菜能获得较多的维生素C,维生素C的制剂不能存放太长时间。 通过以上内容可知,维生素C有
、 等性质。
(3)小明同学运用到的实验方法测定( 比较)西红柿汁液(新鲜和放置一周的)、果味饮料中维生素C含量。
〔实验目的〕测定不同饮料中维生素C的含量。
〔实验试剂〕碘水、淀粉溶液、已知浓度的标准维生素C溶液、蒸馏水
〔实验过程〕
步骤I 在5 支试管中分别盛有3.Oml。下列物质:A 蒸馏水;B 标准维生素C溶液;C新鲜红柿汁液;D 放置一周的西红柿汁液;E 果味饮料。 另分别向5 支试管中滴加2 滴淀粉溶液。
步骤Ⅱ 用胶头滴管向A 试管中滴加1 滴碘水,试管中物质变蓝色。
步骤Ш 按相同的操作方法向 B 中滴加1 滴碘水,振荡试管,再加l 滴碘水,再振荡试
管,重复上述操作至试管中物质刚好变成蓝色为止。 记录向B 试管中加人碘水的滴数。
步骤Ⅳ 对于 C、D、E 试管中样品,重复步骤Ш的操作。
〔实验结果〕
| 测定物质 | A蒸馏水 | B标准维生素 C溶液 | C新鲜红柿 汁液 | D放置一周的西红柿汁液 | E果味饮料 |
| 滴入碘水 的数量(滴) | 1 | 8 | 11 | 6 | 5 |
试回答以下问题:
①你认为小明测定的液体中,哪一种的维生素C含量较高?
。
②有人认为测物质B 是多余的,你认为呢?请说明理由。
。
③化学实验需要控制变量. 下列哪些情况会影响到测定结果? 。
a. 饮料的颜色不同
b. 取的被测试物质的体积不同
c. 没有用同一规格胶头滴管按相同的操作方法向 A、B、C、D、E 中滴加碘水
d. 试管的大小不同
④你从以上实验中得到的启示有 。
19.(8分) 1932年,美国化学大师Linus Pauling提出电负性(用希腊字母x表示)的概念,用来确定化合物中原子某种能力的相对大小。Linus Pauling假定F的电负性为4,并通过热化学方法建立了其它元素的电负性。LhlusPauhg建立的有关元素的电负性如下:
| H:2.1 | ||||||
| Li:1.0 | Be:1.5 | B:2.0 | C:2.5 | N:3.0 | O:3.5 | F:4.0 |
| Na:0.9 | Mg:1.2 | A1:l.5 | Si:1.8 | P:2.1 | S:2.5 | Cl:3.0 |
| K:0.8 | Ca:1. 0 | Ga:l.6 | Ge:1.8 | As:2.0 | Se:2.4 | Br:2.8 |
| Rb:0.8 | Sr:1.0 | In:l.7 | Sn:1.8 | Sb:1.9 | Te:2.0 | I:x |
| Cs:0.7 | Ba:0.9 | Tl:1.8 | Pb:1.9 | Bi:1.9 | Po:2.0 | At:2.2 |
| Fr:0.7 | Ra:0.9 |
回答下列问题:
(1) 预测I元素x的取值范围
(2) 观察上表可得出如下结论:一般情况下,金属元素的电负性越小,它的金属活动性就越 (选填“强”或“弱”),金属元素钛和镍的电负性分别为1.6和1.8,由此请你预测钛、镍和铝的金属活动性由强到弱的顺序为 。
(3) 大量事实表明,当两种元素的x值相差大于或等于1.7时,形成的化合物一般是离子化合物。根据此经验规律,AlCl3物质 (选填“是”或“不是”)离子化合物。
20.(5 分)读我国某地6 月22 日气温、太阳辐射变化图和其所在区域图,回答问题。
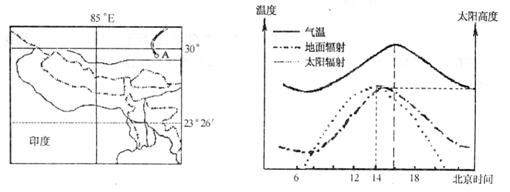
(1)左图中通往日光城A 的铁路线是 铁路,该铁路已于2006年7月通车。
(2)左图A 所在区域处在 板块与 板块交界处。
(3)从右图可推算出,该地经度为 。
(4)该地当天气温变化的特点是 。
21.(4分)你玩过手电筒吗?当如箭头“↓”和“↙”摆放手电筒时,你发觉手电筒的亮光有什么变化? 。
想一想:早上和中午的阳光哪时更强烈? 。同样是中午时的太阳,冬天和夏天哪时更强烈? 。
 22.(6 分))已知在稀盐酸中逐滴滴入碳酸钠溶液时发生以下反应:Na2CO3+2HCl=2NaC1+
CO2↑十H20;在碳酸钠中逐滴滴入稀盐酸时先发生以下反应:
22.(6 分))已知在稀盐酸中逐滴滴入碳酸钠溶液时发生以下反应:Na2CO3+2HCl=2NaC1+
CO2↑十H20;在碳酸钠中逐滴滴入稀盐酸时先发生以下反应:
Na2CO3 + HC1 = NaHCO3+ NaC1,然后才发生反应:
NaHCO3+HC1= NaC1 + C02 ↑+H20。
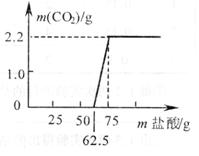
甲、乙两位同学对实验室久置的Na0H 的变质程度进行探究。先称取13.3g 的NaOH 样品(杂质为Na2CO3),配成溶液,然后向溶液中逐滴加入质量分数为14.6%的稀盐酸,实验测得加入稀盐酸的质量与产生C02气体的质量关系如图所示。
(1)计算样品中所含氢氧化钠的质量。
甲、乙两同学分别按以下方法计算,请你帮他们求出结果。
甲同学根据二氧化碳的质量,求出了碳酸钠的质量,进而求得样品中所含氢氧化钠的质量为 。
乙同学认为产生气体前反应掉的62.5 g 盐酸全部被氢氧化钠所消耗,根据盐酸的质量求得氢氧化钠的质量为 。
(2)按甲、乙两位同学的方法所求出的氢氧化钠的质量并不相同,按 (选“甲”或“乙”)同学的方法求得的结果正确,这是因为 。
23.(10 分)为了研究某一特殊材料制成的导体元件L的电学特性,长江中科学探究小组通过实验,测得通过该元件的电流 I 与电压 U 加在它两端电压的实验数据如下表所示:
| U/V | 0 | 1 | 2 | 3 | 4 | 5 |
| I/(×10-3A) | 0 | 20 | 80 | 180 | 320 | 500 |
(1)观察表中的实验数据,探究小组的同学对I与U间的关系提出了以下的猜想:
猜想甲:通过导体元件L的电流可能与加在它两端的电压成正比。
猜想乙:通过导体元件L的电流可能与加在它两端的电压德平方成正比。
猜想丙:加在导体元件L两端的电压可能与通过它的电流的平方成正比。
经分析与论证,你认为,表中的实验数据支持上述哪种猜想?
答: 。(2分)
(2)进一步分析可得出:通过导体元件L 的电流I 与加在它两端电压U之间的关系式为:
I= 。(2分)
(3)现将用该导体元件L 与一个遵从欧姆定律的电阻器 R2 串联在一起后,接在6V电源上。当串联的电阻器阻值 R2是多少时,电路中的电流为O.08A? (3 分)
(4)若将导体元件L 与 R3 串联按在同一电源上,当串联的电阻器阻值 R3是多少时,导体元件 L 消耗的电功率是电阻 R3 消耗功率的2倍 ?(3 分)
科学参考答案
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 答案 | C | B | D | A | C | A | B | A |
| 题号 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
| 答案 | C | B | C | C | C | B | A | A |
17. 环已烷 C6H12
18.(1)酸 碱 (2)受热易分解易溶于水(或易被氧化)
(3) ①新鲜西红柿汁液
②不是多余的,因为测定物质B 是为了确定维生素C含量的标准
③ abc
④要吃新鲜的蔬菜和水果;有坏血酸的病人要多吃含维生素C高的蔬菜和水果(其它合理答案也可)
19.(1)2.2~2.8 (2)强 铝、钛、镍 (3)不是
20.(1)青藏铁路 (2)亚欧,印度洋 (3) 90°E
(4) 当天气温日出前后气温最低,当地正午过后2 小时左右气温最高(北京时间7 点最低,16 点最高)
21. (1)手电筒在同一高度的“↓”和“↙”两种放法中,“↓”放法形成的光斑更加明亮,“↙”放法形成的光斑则显得暗淡。(2分) 中午 (1分) 夏天(1分)
22.(1)(4分)8g 10g
(2)(2 分) 甲同学正确. 因为氢氧化钠反应完后,往碳酸钠中逐滴滴入稀盐酸时,碳酸钠先与盐酸反应生成碳酸氢钠,不会马上产生气体,因此 62.5g 盐酸不是全部被氢氧化钠所消耗。
23.(1)猜想乙;
(2)I=2×10-2 U2(或I=U2/50)
(3)由实验结论I=2×10-2 U2可知,
L两端电压为U2=U-U1
R2=![]() =
=![]() Ω=50Ω
Ω=50Ω
(4) 由于电阻R3与代替串联,要使导体消耗的功率是电阻R3的2倍。
则 U1´′=2U2′, 即U1′=4V, U3=2V,
由I=2×10-2 U2 ,
得I′=2×10-2 ×42A=![]() A,
A,
即R3=U3/I′=2×25/8Ω=6.25Ω