2006年揭阳市高考化学第二次模拟试题
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分;
可能用到的原子量:H 1 C 12 N 14 O 16 Cu 64
第Ⅰ卷(选择题 共68分)
一、选择题(本题包括8小题,每小题3分,共24分。每小题只有一个选项符合题意。)
1、 我国在已探明的化石能源资源总量中,煤炭占90%以上,然而,煤炭能源的大量利用会对环境造成严重污染,因此,洁净煤这一绿色化学技术正方兴未艾。下列措施不属于洁净煤技术的是 ( D )
A、溶剂萃取脱硫法 B、煤的气化(产物主要为CO和H2)
C、煤的加氢液化 D、煤的直接燃烧
2、已知下列氧化剂均能氧化+4价硫元素,为了除去稀H2SO4中混有的H2SO3,以得到纯净
的稀H2SO4,最合理的氧化剂是 ( C ) A.KMnO4 B.Ca(ClO)2 C.H2O2 D.Cl2
3、A和M为两种元素,已知A位于短周期,且A2-与M+的电子数之差为8,则下列说法正确的是( A )
A A和M原子的电子总数之和可能为11 B. A和M的原子序数之差为8
C.A和M原子的最外层电子数之和为8 D.A和M原子的最外层电子数之差为7
4、在托盘天平的两盘中各放入同浓度同体积的足量稀硫酸,分别加入0.1mol两种金属,反应后需在游码中拔动0.2g后,天平才能恢复平衡。两金属是 ( A )
A.镁和铝 B.铁和铝 C.镁和钠 D.铁和铜
5、下列叙述,从化学角度分析不正确的是(D)
A.被蜂蚁蛰咬后,可涂抹稀氨水或小苏打溶液减轻疼痛
B.农业上常用福尔马林溶液来浸种,原因是福尔马林具有杀菌和防腐作用
C.向燃料煤中加入生石灰,可以减少对大气的污染
D.氟利昂(![]() )或
)或![]() 都可以破坏臭氧层,而导致温室效应
都可以破坏臭氧层,而导致温室效应
6、用惰性电极实现电解,下列说法正确的是 ( B )
A、电解硫酸钠溶液,在阴极上和阳极上析出的产物的物质的量之比为1:2
B、电解氯化铜溶液,在阴极上和阳极上析出的产物的物质的量之比为1:1
C、电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
D、电解稀氢氧化钠溶液,要消耗OH―,故溶液的pH减小
7、某无色透明溶液中,由水电离出来的c(H+)=1×10-13mol/L,在该溶液中一定能够大量共存的离子组是 ( A )
A、K+、Na+、SO42-、NO3- B、Fe3+、A13+、Cl-、HS-
C、NH4+、A1O2-、Na+、CH3COO- D、K+、Na+、MnO4-、NO3-
8、等质量的两份锌粉a、b,分别加入过量的稀H2SO4,同时向a中加入少量的CuSO4溶液,下列图表示产生H2的体积(V)与时间(t)的关系,其中正确的是 ( D )
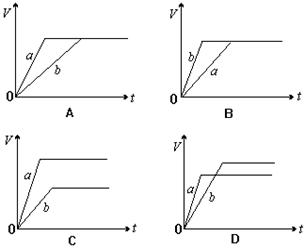
二、选择题(本题包括11小题,每小题4分,共44分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的4分,但只要选错一个,该小题就为0分)
9、2005年3月28日,据CCTV报道,由中南大学研制成功的碳-碳新材料和西北工业大学研制而成的耐高温长寿命抗氧化陶瓷,这些新型材料可广泛应用于太空领域,具有世界领先水平,双双荣获国家科学技术发明一等奖。关于这两种新型材料下列说法正确的是 ( BD )
A、它们均为原子晶体化合物 B、它们均为非电解质
C、它们均能导电、导热 D、它们都具有耐磨和很高的硬度
10、类推的思维方法在化学学习和研究中常会产生错误的结论,因此类推出的结论最终要经过实践的检验才能决定其正确与否。下列几种类推结论中不正确的是 ( BC )
A、Mg失火不能用CO2灭火;Na失火也不能用CO2灭火
B、Fe3O4可写成FeO·Fe2O3;Pb3O4也可写成PbO·pb2O3
C、不能用电解熔融AlCl3来制取金属铝;也不用电解熔融MgCl2来制取金属镁
D、Fe与S直接化合生成FeS;Al与S直接化合也可以得到Al2S3
11、下列事实中,不能用勒夏特列原理(平衡移动原理)解释的是 ( B )
A、合成氨工业上,采用高压以提高NH3的产率
B、在FeSO4溶液中加入少量铁粉以防止Fe2+被氧化
C、实验室中常用排饱和食盐水的方法收集Cl2
D、工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
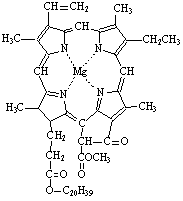 12、我国科学工作者合成了许多结构复杂的天
12、我国科学工作者合成了许多结构复杂的天
然有机化合物,如叶绿素、血红素、维生素
B12等。叶绿素的结构如右图。下列有关说法
中正确的是:( C D)
A.叶绿素属于高分子化合物
B.在一定条件下,叶绿素能发生加成、水解、
酯化等反应
C.叶绿素不属于芳香族化合物
D.叶绿素分子中含有三种类型的双键
13、在体积都为1 L,pH都等于2的盐酸和醋酸溶液中,投入0.65 g锌粒,则下图所示比较符合客观事实的是 ( C )

14、下列反应的离子方程式书写正确的是 ( AD )
A、用铂电极电解饱和NaCl溶液:2Cl-+2H2O![]() 2OH-+H2
2OH-+H2![]() +Cl2
+Cl2![]()
B、氢氧化铁与氢碘酸混合:Fe(OH)3 + 3H+ = Fe3+ +3H2O
C、次氯酸钙溶液中通入过量的SO2: ClO- + H2O + SO2 =HSO3- + HClO
D、新制氯水中滴入少量溴化亚铁溶液: 2Fe2+ + 4Br- + 3Cl2 = 2Fe3+ + 2Br2 + 6 Cl-
15、某溶液中含有![]() 、
、![]() 、
、![]() 、
、![]() ,加入下列试剂,分别得到各含一种金属阳离子的沉淀.①通入
,加入下列试剂,分别得到各含一种金属阳离子的沉淀.①通入![]() 气体 ②通入
气体 ②通入![]() 气体 ③加入盐酸 ④加入NaOH溶液.每次加入的试剂均过量且每次都把沉淀物滤出,其中实验操作的正确顺序是( B )
气体 ③加入盐酸 ④加入NaOH溶液.每次加入的试剂均过量且每次都把沉淀物滤出,其中实验操作的正确顺序是( B )
A、①③④② B、③①④② C、④②①③ D、④②③①
16、向NaBr、NaI、Na2SO3混合溶液中,通入一定量的氯气后,将溶液蒸干并灼烧,得到的剩余固体的组成可能是 (AB)
A. NaCl Na2SO4 B.NaCl NaBr Na2SO4
C. NaCl Na2SO4 I2 D.NaCl NaI Na2SO4
17、将7.84g铁粉加入200mL 2mol·L-1的HNO3溶液中,使之充分反应放出NO气体,所得
溶液中,主要离子浓度的大小关系符合下列的 ( A )
A.![]() (NO
(NO![]() )>
)>![]() (Fe2+)>
(Fe2+)>![]() (Fe3+)>
(Fe3+)>![]() (H+)
(H+)
B.![]() (NO
(NO![]() )>
)>![]() (Fe3+)>
(Fe3+)>![]() (Fe2+)>
(Fe2+)>![]() (H+)
(H+)
C.![]() (Fe2+)>
(Fe2+)>![]() (Fe3+)>
(Fe3+)>![]() (NO
(NO![]() )>
)>![]() (H+)
(H+)
D.![]() (Fe2+)>
(Fe2+)>![]() (NO
(NO![]() )>
)>![]() (Fe3+)>
(Fe3+)>![]() (H+)
(H+)
18、 甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是( A )
A.甲中由水电离出来的H+的物质的量浓度是乙中由水电离出来的H+的物质的量浓度的1╱10倍
B.物质的量浓度c(甲)=10c(乙)
C.中和等物质的量的NaOH溶液需甲、乙两杯酸的体积,10V(甲)>V(乙)
D.甲中的c(OH-)为乙中c(OH-)的10倍
19、pH=11的x,y两种碱溶液各10mL,分别稀释至1000mL,其pH与溶液体积(V)的关系如图所示,下列说法正确的是 ( BC )
A、x、y两种碱溶液都是一元碱,则原两者溶液的物质的量浓度一定相等
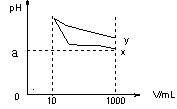 B、稀释后x溶液水电离的c(H+)比y溶液水电离的c(H+)大
B、稀释后x溶液水电离的c(H+)比y溶液水电离的c(H+)大
C、若9<a<1l,则x、y都是弱碱
D、完全中和x,y两溶液时,消耗同浓度盐酸的体积Vx>Vy
第Ⅱ卷(共82分)
三、(本题包括2小题,共22分)
20、(6分)下面a~e是中学化学实验中常见的几种定量仪器:
a.量筒 b.容量瓶 c.滴定管 d.托盘天平 e.温度计
(1)其中标示出仪器使用温度的是 (填写编号,下同)
(2)能够用以精确量取液体体积的是
(3)由于错误操作, 使得到的数据比正确数据偏小的是
A.使用容量瓶配制溶液时, 俯视液面定容后所得溶液的浓度
B.没有用蒸馏水洗烧杯2—3次,并将洗液移入容量瓶中
C.容量瓶刚用蒸馏水洗净,没有烘干
D.定容时,滴加蒸馏水,液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
21、(16分)实验室中有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
请完成下列填空:
(1) 配制100mL 0.10mol/L NaOH标准溶液。
①主要操作步骤:计算→称量→溶解→(冷却后) →洗涤(并将洗涤液移入容量瓶)→ → →将配制好的溶液倒入试剂瓶中,贴上标签。
②称量0.4克氢氧化钠固体所需仪器有:天平(带砝码、镊子)、 、 。
(2) 取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。
| 实验编号 | NaOH溶液的浓度 (mol/L) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸溶液的体积 (mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
①滴定达到终点的标是 。
②根据上述数据,可计算出该盐酸的浓度约为 (保留两位有效数字)
③排去碱式滴定管中气泡的方法应采用操作 ,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
![]()

![]()
甲 乙 丙
④在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。(多选扣分)
A、滴定终点读数时俯视读数
B、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C、锥形瓶水洗后未干燥
D、称量前NaOH固体中混有Na2CO3固体
E、配制好的NaOH标准溶液保存不当,部分与空气中的CO2反应生成了Na2CO3
F、碱式滴定管尖嘴部分有气泡,滴定后消失
21、(12分) 某学生有0.10mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
(A)取标准KOH溶液注入碱式滴定管至0刻度以上2-3cm
(B)用标准溶液润洗滴定管2-3次
(C)把盛有标准溶液的碱式滴定管固定好,调节液面使滴定管尖嘴充满溶液
(D)移取20.00mL待测的盐酸溶液注入洁净的锥形瓶,并加入2-3滴酚酞
(E)把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点,并记下滴定管液面的刻度
(F)调节液面至0或0刻度以下,记下读数
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)______________________.
(2)上述(B)操作的目的是___________________________________。
(3)上述(D)操作之前,如先用待测液润洗锥形瓶,则对测定结果的影响是(填偏大、偏小、不变,下同)_________________________。
(4)实验中用左手控制____________(填仪器及部位),眼睛注视____________________,直至滴定终点。判断到达终点的现象是________________________________________。
(5)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并有来滴定上述盐酸,则对测定结果的影响是___________________________________________________-。
(6)滴定结束后如俯视观察滴定管中液面刻度,则对滴定结果的影响是______________
四、(本题包括2小题,共20分)
22、(10分)有pH均为2的盐酸、硫酸、醋酸三瓶溶液:
(1)设三种溶液的物质的量浓度依次为c1、c2、c3,则其关系是_________________(用“>、<、=”表示,下同)。
(2)取同体积的三种酸分别加蒸馏水稀释到pH=6,需水的体积依次为V1、V2、V3,则其关系是_________________。
(3)完全中和体积和物质的量浓度均相同的三份NaOH溶液时,需三种酸的体积依次为V1、V2、V3,则其关系是____________________。
(4)取同体积的酸的溶液分别加入足量的锌粉,反应开始放出H2的速率依次为a1、a2、a3,则其关系是_______________________;反应过程中放出H2的速率依次为b1、b2、b3,则其关系是________________________。
22、(8分)北京时间10月15日9时42分,我国在酒泉卫星发射中心成功的发射了“神舟”五号载 人飞船。这标志着“炎黄子孙千年飞天梦想实现了,中国人的太空时代开始了。” ⑴ 火箭升空时,由于与大气层的剧烈摩擦,产生高温。为了防止火箭温度过高, 在火箭表面涂上一种特殊的涂料,该涂料的性质最可能的是
A.在高温下不融化 B.在高温下可分解气化
C.在常温下就分解气化 D.该涂料不可能发生分解
⑵ 火箭升空需要高能的燃料,经常是用N2O4和N2H4作为燃料,其反应的方程式是:
N2 O4 + N2H4
→ N2
+ H2O 。请配平该反应方程式:
N2O4 + N2H4 = N2 + H2O
该反应中被氧化的原子与被还原的原子物质的量之比是 。
这个反应应用于火箭推进器,除释放大量的热和快速产生大量气体外,还有一个很大的优点是
。
⑶ 为了向宇航员提供氧气,飞船上有专门的供氧装置。现有供氧剂过氧化钠与超氧化钾(KO2)。① 写出它们与二氧化碳反应的化学方程式(超氧化钾与二氧化碳的反应产物与过氧化钠类似):
;
。
② 你选择的供氧剂是: ,原因是:
。
23、(12分)现有物质A~I,其转化关系如下图,已知:A为两种元素组成的化合物,B不溶于水,X常温下为无色液体,E常温下为红棕色气体。(反应中生成的其它物质已略去)
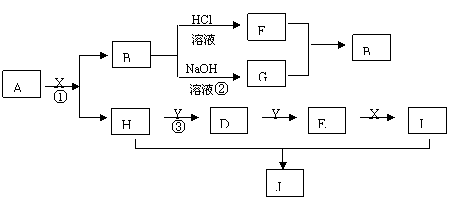 |
根据上述转化关系图回答:
1)写出下列物质的化学式
X J
2)物质H的电子式:
物质J是属于哪种晶体类型:
3)按要求写出下列方程式
写出反应①的化学方程式 ;
写出反应③的化学方程式 ;
写出反应②的离子方程式 。
五、(本题包括2小题,共22分)
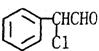
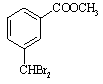
24、(12分)中国是《日内瓦协定书》的缔约国,一贯反对使用化学武器,反对任何形式的化学武器扩散。苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式为:![]() ,试回答下列问题:
,试回答下列问题:
(1)苯氯乙酮分子中,在同一平面上的碳原子最多有 个。
(2)苯氯乙酮不可能具有的化学性质是:_____________(填序号)。
A.加成反应 B.取代反应 C.消去反应 D.水解反应 E.银镜反应
(3)与苯氯乙酮互为同分异构体,且能发生银镜反应,分子有苯环但不含—CH3,的化合物有多种,它们的结构简式是:
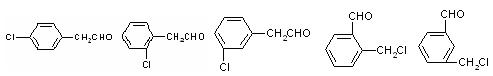
请写出与上述不同的两种同分异构体: ; 。
25、(12分)已知两个羟基同时连在同一碳原子上的结构是不稳定的,它要发生脱水反应:
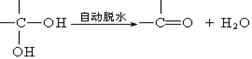
现有分子式为C9H8O2X2(X为一未知元素)的物质M,可在一定条件下发生上述一系列反应 :
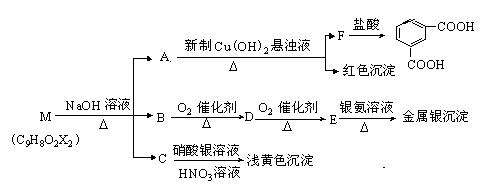
试回答下列问题:
⑴ X为 (填元素符号);
⑵A中所含的官能团为 (填名称),上述转化中其中属于氧化反应的共有_________步(填数字);M与NaOH溶液共热时的反应类型是 反应。
⑶ M的结构简式为 。
⑷写出下列反应的化学方程:
①B→D ;
②D在一定条件下发生加聚反应: ;
③E和银氨溶液反应的化学方程式: 。
六、(本题包括2小题,共18分)
26、(6分)现有100mLH2SO4和HCl的混合溶液,用酸式滴定管取20.00mL该混合溶液注入锥形瓶中,再滴加2滴酚酞试液,然后向其中逐滴加入0.05000mol/L Ba(OH)2溶液至溶液恰好变为红色,共消耗Ba(OH)2溶液20.00mL,生成的沉淀经过滤、洗涤、干燥后精确称量得质量为0.1165g。
1)试计算原溶液的pH
2)试计算原混合溶液中H2SO4和HCl的物质的量浓度
26、(7分)粉末状式样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
① 取适量A进行铝热反应,产物中有单质B生成;
②另取20gA全部溶于0.15L0.6mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是 ,产物中单质B是 。
(2)③中所发生反应的各反应的离子方程式是 。
(3)若溶液D的体积仍视为0.15L,则溶液中c(Mg2+)为 ,c(Fe2+)为 。
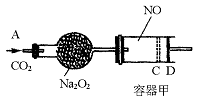 27、(12分)右图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量
27、(12分)右图装置中,容器甲内充入0.1 mol NO气体,干燥管内装有一定量![]() ,从A处缓慢通入
,从A处缓慢通入![]() 气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的
气体.恒温下,容器甲中活塞缓慢由D向左移动,当移至C处时容器体积缩小至最小,为原体积的![]() ,随着
,随着![]() 的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
的继续通入,活塞又逐渐向右移动。(不考虑活塞的磨擦)
(1)①已知当活塞移至C处时,干燥管中物质的质量增加了2.24 g.此时,通入标准状况下的![]() 气体多少L?容器甲中
气体多少L?容器甲中![]() 转化为
转化为![]() 的转化率是多少?
的转化率是多少?
②活塞移至C处后,继续通入![]() ,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是
_。
,此时活塞恰好回至D处.则a值必 0.01(填大于、小于、等于),其理由是
_。
(2)若改变干燥管中![]() 的量,要通过调节甲容器的温度及通入
的量,要通过调节甲容器的温度及通入![]() 的量,使活塞发生从D到C,又从C到D的移动,则
的量,使活塞发生从D到C,又从C到D的移动,则![]() 的质量最小值应大于________g。
的质量最小值应大于________g。
27、(12分)某化工厂以硫磺为原料生产硫酸.设空气中的氧气的体积分数为0.20,且不考虑各生产阶段的物料损失.试完成下列各题:
(1)如果该厂生产98%的硫酸10t.
①需要原料硫磺的质量是________t.
②需要消耗空气的体积(标准状况)为________![]() .
.
(2)如果该厂每天生产98%的硫酸at,在生产过程中为了使硫充分燃烧,且在下一步催化氧化时不再补充空气,要求硫燃烧后的混合气体中氧气的体积分数为b.已知该厂每天消耗空气2.24×![]() (标准状况).
(标准状况).
①写出a和b的关系式.
②在图7-8中画出a和b的关系曲线.
图7-8
参考答案及评分标准
选择题:
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | |
| 答案 | D | C | A | A | D | B | A | D | BD | |
| 题号 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 |
| 答案 | BC | B | C | C | AD | B | AB | A | A | BC |
20、(6分) (每空2分)(1) a、b、c (只选一个不得分,只选两个且正确得1分,选三个且都正确得2分,但只要错选一个得0分) (2)c (3)BD(选对一个得1分,选对两个得2分)
21、(16分)(1)①转移;定容;摇匀 ②烧杯(或表面皿);药匙;每空1分
(2)①最后一滴氢氧化钠溶液加入,溶液由无色恰好变成浅红色(答由无色变成红色即可)
②0.11mol/L(不写单位不给分) ③丙;D、F;(选对一个得2分,错选一个倒扣2分)
21、(1)BACFDE(2分) (2)防止将标准液稀释(1分) (3)偏大 (2分)
(4)滴定管玻璃球(1分);锥形瓶中溶液的颜色变化(1分);锥形瓶中溶液的颜色由无色变浅红且保持30秒内不褪色。(1分) (5)偏小 (2分) (6)偏小(2分)
22.(10分,每空2分)
(1)c2<c1<c3或c3>c1>c2
(2)V1=V2<V3
(3)V1=V2>V3
(4)a1 = a2 = a3 b1 = b2 < b3
22、(8分)⑴ B;
⑵ 1N2O4 + 2N2H4 = 3N2 + 4H2O 2∶1;产物无污染。
⑶ ① 2Na2O2 + 2CO2 = 2Na2CO3 + O2 ;4KO2+ 2CO2 = 2K2CO3 + 3O2 。
② KO2,原因是:单位质量产生氧气多。
23、(12分)1)X:H2O; J:NH4NO3(每空1分)
··
2)H:N:H 离子晶体(每空2分)
··
H
3)AlN + 3H2O = Al(OH)3↓+ NH3↑;4NH3 + 5O2 = 4NO + 6H2O;Al(OH)3 + OH- = AlO- + 2H2O
24、(10分)(1)8;(2分) (2)C、E ;(4分)
|
|
25、 ⑴Br (1分) ⑵ 醛基(1分) ; 4步(1分);取代(或水解)(1分)
 ⑶
(2分)
⑶
(2分)
![]() ⑷ ①2 CH3OH+O2 2HCHO
+2H2O (2分)
⑷ ①2 CH3OH+O2 2HCHO
+2H2O (2分)
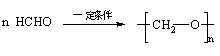 |
②
(2分)
![]() ③HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O (2分)
③HCOOH+2Ag(NH3)2OH (NH4)2CO3+2Ag↓+2NH3↑+H2O (2分)
(每个反应式全对各得2分,条件不写扣1分。第⑷②反应中氧化产物写成CO2、H2CO3或NH4HCO3 (HOCOONH4)均可以,只要反应式写对且配平都给分)
26、(6分)1)c(H2SO4)=0.025mol/L;c(HCl)=0.05mol/L;2)1(答案错不给分)
26、(1)引发铝热反应的条件是:加少量的KCl03,插上镁条并将其点燃。
(2)由题目③可知溶液c中含盐酸,由④可知溶液D中无Fe3+。因此(3)中所发生的反应为:
Fe+2Fe3+=3Fe2+ Fe+2H+=Fe2++H2↑
(3)设20gA中MgO和Fe203的物质的量均为x mol。
![]() 2 Fe3++Fe=3
Fe2+ Fe+2H+=Fe2++H2↑
2 Fe3++Fe=3
Fe2+ Fe+2H+=Fe2++H2↑
2x 3x 1mol 1mol n(Fe2+)=n(H2)
D溶液中Fe2+的物质的量为(3x+0.05)mol
利用电荷守恒关系:2c(Mg2+)+2c(Fe2+)=c(cl-)
2x+2(0.05+3x)=0.15L×6.0mol·L-1=0.90mol解得:x=0.1mol
27、(12分)(1)①(4分)![]() 体积1.792 L;25%
体积1.792 L;25%
②(4分)小于;当活塞由C向D移动时,因体积扩大使平衡:![]()
![]()
![]() 向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
向体积扩大方向移动以至混合气体物质的量增大.增大的物质的量可由下式求出
![]()
![]()
![]()
起始: 0.08 mol 0
平衡:![]()
![]()
因平衡时混合气体总的物质的量为0.07 mol,由于活塞由C移至B,体积扩大,故![]() ,可知充入
,可知充入![]() 物质的量必小于0.01 mol (2)(4分)1.56 g
物质的量必小于0.01 mol (2)(4分)1.56 g
27、(12分)(1)①3.2t ②16800![]()
(2)①![]()
②
附:1、l,5一戊二醛(简称GA),是一种重要的饱和直链二元醛。2%的GA溶液具有广谱、高效、无刺激、无腐蚀等特点,对禽流感、口蹄疫、猪瘟等疾病有良好的防治作用。根据上述信息,判断下列说法中正确的是(D)
(A)戊二醛分子式为C5H1002,符合此分子式的二元醛有4种
(B)戊二醛不能在加热条件下和新制备的氢氧化铜反应
(C)戊二醛不能使酸性KMn04溶液褪色
(D)2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用
2、在下列化学反应中,既有离子键、极性键、非极性键断裂,又有离子键、极性键、非极性键形成的是(B)
(A)Na202+2H20=4NaOH+02
![]() (B)CaC2+H20-->Ca(OH)2+CH CH↑
(B)CaC2+H20-->Ca(OH)2+CH CH↑
(C)Mg3N2+6H20=3Mg(OH)2↓+2NH3↑
(D)NH4Cl+NaOH—NaCI+H@0+NH3↑
3、下列说法正确的是
(A)任何化学反应都伴随着能量的变化
(B)1 mol H2S04和l mol Ba(OH)2完全反应所放出的热量称为中和热
(c)在101kPa时,l mol碳燃烧放出的热量就是碳的燃烧热
(D)在化学反应中需要加热的反应就是吸热反应
4、做实验时不小心粘了一些高锰酸钾,皮肤上的黑斑很久才能消除,如果用草酸稀溶液洗涤马上可以复原,其离子方程式为:MnO4—+C2O42—+H+→CO2↑+Mn2++ 。关于此反应的叙述正确的是(A)
A.该反应的还原剂是C2O42— B.该反应右边方框内的产物是OH—
C.该反应电子转移总数是5e— D.配平该反应后,H+的系数是8
5、某密闭容器中进行如下反应:X(g)+2Y(g)![]() 2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量之比应满足( D
)
2Z(g),若要使平衡时反应物总物质的量与生成物总物质的量相等,则X、Y的初始物质的量之比应满足( D
)
A.
1<![]() <3
B.
<3
B.![]() <
<![]() <
<![]()
C.3<![]() <4
D.
<4
D.![]() <
<![]() <
<![]()
6用pH试纸测定某氨基酸溶液的pH,如果先将pH试纸用蒸馏水润湿后,再把待测液滴到pH试纸上,跟比色卡对照,溶液pH的测得值为8,则该氨基酸溶液的实际pH( D )
A.小于8 B.等于8 C.小于7 D.大于8
7、下列说法正确的是( A )
A.0.020 mol/L的HCN(aq)与0.020 mol/L NaCN(aq)等体积混合得到碱性混合溶液中:
c(Na+)> c(CN-)
B.某二元弱酸的酸式盐NaHA溶液中: c(H+)+c(A2-)=c(OH-)十c(H2A)
C.在物质的量浓度均为0.01mol/L的CH3COOH和CH3COONa的混合溶液中:
c(CH3COOH)+c(CH3COO-)=0.01 mol/L
D.c(NH4+)相等的(NH4)2SO4溶液、NH4HCO3溶液、NH4Cl溶液:
c[(NH4)2SO4] > c(NH4HCO3) > c(NH4Cl)