高考热点专题测试卷:专题十 化学计算
说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.
第Ⅰ卷(共83分)
一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中.
1.过渡元素钴(Co)有多种可变化合价.将![]() 在纯净氧气中加热可得到8.3 g钴的氧化物,则
在纯净氧气中加热可得到8.3 g钴的氧化物,则![]() 在纯氧中受强热发生反应的化学方程式是( )
在纯氧中受强热发生反应的化学方程式是( )
A.![]()
B.![]()
C.![]()
D.![]()
2.有一系列有机物按以下顺序排列:![]() ,
,![]() ,
,![]() ,……在该系列有机物中,分子中含碳元素的质量分数的最大值接近于( )
,……在该系列有机物中,分子中含碳元素的质量分数的最大值接近于( )
A.95.6% B.92.3% C.85.7% D.75.0%
3.取20 g混有二氧化锰的氯酸钾,加热至恒重,在一定温度下将残留的固体加入10 g水中有7.9 g固体未溶解,再加入5 g水仍有5.3 g固体未溶解,原混和物中可能含有的![]() 质量为( )
质量为( )
①14.7 g ②6.9 g ③12.1 g ④17.6 g
A.①② B.①④ C.②③ D.①②③④
4.下图是几种盐的溶解度曲线,根据曲线判断下列说法正确的是( )

A.40℃时,35 g食盐溶于100 g水中,降温至0℃时,可析出氯化钠晶体
B.20℃时,硝酸钾饱和溶液的质量分数是31.6%
C.60℃时,200 g水中溶解80 g硫酸铜达饱和,当降温至30℃时,可析出30 g硫酸铜晶体
D.30℃时,将35 g硝酸钾和35 g食盐同时溶于100 g水中,蒸发时先析出的是氯化钠
5.现有一由![]() 、
、![]() 、
、![]() 组成的混和物,经测定硫的质量分数为25.6%,则此混合物中氧元素的质量分数应为( )
组成的混和物,经测定硫的质量分数为25.6%,则此混合物中氧元素的质量分数应为( )
A.37.6% B.36.8% C.25.6% D.51.2%
二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中.
6.在常温常压下,将40 mL NO和![]() 的混和气,与
的混和气,与![]() 混合,跟水充分反应吸收后,还剩余6 mL无色气体,则原混合气体的组成是( )
混合,跟水充分反应吸收后,还剩余6 mL无色气体,则原混合气体的组成是( )
A.8 mL NO,![]() B.10 mL NO,
B.10 mL NO,![]()
C.20 mL NO,![]() D.29 mL NO,
D.29 mL NO,![]()
7.将![]() 加热到全部转化为气体后,将气体先通过
加热到全部转化为气体后,将气体先通过![]() ,固体质量增加x g;再通过浓
,固体质量增加x g;再通过浓![]() ,浓
,浓![]() 增重y g,若先通过浓
增重y g,若先通过浓![]() ,液体质量增加z g,再通过
,液体质量增加z g,再通过![]() ,固体质量增加W g,则x、y、z、W由大到小顺序是( )
,固体质量增加W g,则x、y、z、W由大到小顺序是( )
A.x>y>z>W B.W>z>y>x
C.y>z>W>x D.z>y>x>W
8.将20 mL二氧化氮和氨的混合气体在一定条件下充分反应,化学方程式是:![]() ,已知参加反应的二氧化氮比氨少2 mL(气体体积均在相同状况下测定),则原混和气体中二氧化氮和氨所占体积比( )
,已知参加反应的二氧化氮比氨少2 mL(气体体积均在相同状况下测定),则原混和气体中二氧化氮和氨所占体积比( )
A.3∶2 B.2∶3 C.3∶4 D.3∶7
9.含有![]() 的稀溶液,恰好使5.6 g铁粉完全溶解,若有
的稀溶液,恰好使5.6 g铁粉完全溶解,若有![]() 被还原成NO(无其他还原产物),则n值不可能是( )
被还原成NO(无其他还原产物),则n值不可能是( )
A.12.6 B.16.8 C.18.9 D.25.2
10.短周期中的某金属元素R的无水硝酸盐的式量为m,R的硫酸盐的式量为n,则R的化合价可能为( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
11.用稀![]() 溶解FeS和
溶解FeS和![]() 的混合物56.6 g,可得3.2 g S,原混合物中FeS的质量可能是( )
的混合物56.6 g,可得3.2 g S,原混合物中FeS的质量可能是( )
A.8.8 g B.21.4 g C.35.2 g D.47.8 g
12.20℃时,向50 mL 1 mol/L的![]() 溶液中滴加1 mol/L的盐酸75 mL,在液面上收集所产生的气体,这些气体经干燥后换算为标准状况下的体积为( )
溶液中滴加1 mol/L的盐酸75 mL,在液面上收集所产生的气体,这些气体经干燥后换算为标准状况下的体积为( )
A.840 mL B.560 mL
C.小于840 mL大于560 mL D.略小于560 mL
13.Mg、Al、Fe三种金属的混合物与足量的稀![]() 反应,生成
反应,生成![]() (在标准状况下),则金属混合物中三种金属的物质的量之和不可能是( )
(在标准状况下),则金属混合物中三种金属的物质的量之和不可能是( )
A.0.11 mol B.0.14 mol C.0.08 mol D.0.10 mol
三、选择题:本题包括9个小题,每小题4分,共36分.每小题只有一个选项符合题意.把正确选项的代号填在题后答题卡中.
14.向KI溶液中加入![]() 溶液,直到反应完全为止.结果反应后溶液的质量恰好等于原碘化钾溶液的质量,则该
溶液,直到反应完全为止.结果反应后溶液的质量恰好等于原碘化钾溶液的质量,则该![]() 溶液的质量分数为( )
溶液的质量分数为( )
A.50% B.48.3% C.38.2% D.72.3%
15.将两种硫酸盐按一定比例混合后共熔,可制得化合物X,X溶于水能电离出![]() 、
、![]() 、
、![]() ,若将2.83 g X中的
,若将2.83 g X中的![]() 全部氧化为
全部氧化为![]() 后,溶液中的
后,溶液中的![]() 可和过量KI溶液反应,得到
可和过量KI溶液反应,得到![]() ,反应的离子方程式为:
,反应的离子方程式为:![]()
![]() ,若向溶有2.83 gX的溶液中,加入过量的
,若向溶有2.83 gX的溶液中,加入过量的![]() 溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为( )
溶液,可得到4.66 g白色沉淀.由此可推断出X的化学式为( )
A.![]() B.
B.![]()
C.![]() D.
D.![]()
16.在重水中存在下述电离平衡:![]()
![]()
![]() ,因此,对重水(
,因此,对重水(![]() )可采用pH一样的定义来规定PD,那么
)可采用pH一样的定义来规定PD,那么![]() .已知在某温度下
.已知在某温度下![]() 达电离平衡时,
达电离平衡时,![]() ,则在下列叙述中:①用0.01 mol NaOD和
,则在下列叙述中:①用0.01 mol NaOD和![]() 配成1 L溶液,其PD值等于2;②用0.01 mol DCl溶于
配成1 L溶液,其PD值等于2;②用0.01 mol DCl溶于![]() 中,配成1 L溶液,其PD等于2;③纯净
中,配成1 L溶液,其PD等于2;③纯净![]() 在此温度下的PD大于7;④用
在此温度下的PD大于7;④用![]() 配制
配制![]() 溶液,溶液中
溶液,溶液中![]() 浓度是
浓度是![]() 浓度的3倍.其中说法正确的组合是( )
浓度的3倍.其中说法正确的组合是( )
A.①② B.①④ C.③④ D.②③
17.取一定量的甲烷与少量氧气混合点燃,生成![]() 、CO、
、CO、![]() (气)的混合物49.6 g,将燃烧混合物缓缓通过无水氯化钙并吸收完全,氯化钙的质量增加25.2 g,由此可知甲烷不完全燃烧所得产物中一氧化碳的质量是( )
(气)的混合物49.6 g,将燃烧混合物缓缓通过无水氯化钙并吸收完全,氯化钙的质量增加25.2 g,由此可知甲烷不完全燃烧所得产物中一氧化碳的质量是( )
A.11.2 g B.8.4 g C.5.6 g D.2.8 g
18.把平均式量为51的![]() 和
和![]() 的混合气体A与平均式量为48的
的混合气体A与平均式量为48的![]() 和
和![]() 的混合气体B同时通入一盛满水的倒立于水槽中的容器中,充分反应后溶液充满容器,则A与B的体积比为( )
的混合气体B同时通入一盛满水的倒立于水槽中的容器中,充分反应后溶液充满容器,则A与B的体积比为( )
A.4∶1 B.1∶1 C.2∶5 D.5∶2
19.将分别盛有100 mL的KCl溶液、![]() 溶液、
溶液、![]() 溶液的三个电解槽(电极均为惰性电极)串联,通直流电进行电解,当某极析出0.32 g Cu后,假定各溶液在电解前后的体积未变,则这时三个电解槽中溶液的pH分别是( )
溶液的三个电解槽(电极均为惰性电极)串联,通直流电进行电解,当某极析出0.32 g Cu后,假定各溶液在电解前后的体积未变,则这时三个电解槽中溶液的pH分别是( )
A.13,7,1 B.12,7,2 C.1,7,13 D.7,7,7
20.一定量的乙醇在氧气不足的情况下燃烧,得到CO,![]() 和水的总质量为27.6 g,若其中水的质量为10.8
g,则CO的质量是( )
和水的总质量为27.6 g,若其中水的质量为10.8
g,则CO的质量是( )
A.1.4 g B.2.2 g C.4.4 g D.在2.2 g和4.4 g之间
21.有一包含有不溶性杂质的![]() 样品,将其加入到一定量水中充分搅拌,在10℃时剩余固体为189 g,在40℃时剩余固体为103 g,在75℃时剩余固体为10 g.查
样品,将其加入到一定量水中充分搅拌,在10℃时剩余固体为189 g,在40℃时剩余固体为103 g,在75℃时剩余固体为10 g.查![]() 溶解度有关数据如下:
溶解度有关数据如下:
| 温度(℃) | 10 | 40 | 50 | 60 | 70 | 80 |
| 溶解度(g) | 20.9 | 63.9 | 85.5 | 110 | 150 | 169 |
由此作出的正确结论是( )
A.加入的水为210 g B.原样品中![]() 为179 g
为179 g
C.原样品总质量为230.8 g D.75℃所得的溶液为饱和溶液
22.现有A、B、C三种化合物,各取40 g相混合,完全反应后,得18 g B,49 g C,还有D生成.已知D的式量为106.现将22 g A和11 g B反应,能生成D的物质的量为( )
A.1 mol B.0.5 mol C.0.275 mol D.0.25 mol
答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 分值 | 3分 | 3分 | 3分 | 3分 | 3分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 分值 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 |
第Ⅱ卷(共67分)
四、本题包括2小题,共16分
23.(8分)向W g由NaHS、![]() 、
、![]() 组成的混合物中,加入一定量的水充分反应后过滤.已知滤液中只含有
组成的混合物中,加入一定量的水充分反应后过滤.已知滤液中只含有![]() ,滤渣不溶于稀盐酸,且反应过程中无气体逸出.
,滤渣不溶于稀盐酸,且反应过程中无气体逸出.
(1)滤渣的成分是____________________________;
(2)原混合物中NaHS、![]() 、
、![]() 的物质的量之比是_______;
的物质的量之比是_______;
(3)用离子反应方程式表示滤渣的形式过程_______________________.
24.(8分)对于![]()
![]()
![]() 的体系,在压强一定时,平衡体中
的体系,在压强一定时,平衡体中![]() 的质量分数随温度的变化情况如图所示.(实线上的任何一点为对应温度下的平衡状态)
的质量分数随温度的变化情况如图所示.(实线上的任何一点为对应温度下的平衡状态)
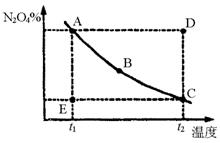
(1)A、B、C、D、E各状态时,![]() 的是__________________________.
的是__________________________.
(2)维持![]() 不变,E→A所需时间为x,维持
不变,E→A所需时间为x,维持![]() 不变,D→C所需时间为y,则x____y(<、>或=)
不变,D→C所需时间为y,则x____y(<、>或=)
(3)欲要求使E状态从水平方向到达C状态后,再沿平衡曲线到达A状态从理论上来讲,可选用的条件是
A.从![]() 无限缓慢升温至
无限缓慢升温至![]() ,再由
,再由![]() 无限缓慢降温至
无限缓慢降温至![]()
B.从![]() 突然升温至
突然升温至![]() ,再由
,再由![]() 无限缓慢降温至
无限缓慢降温至![]()
C.从![]() 突然升温至
突然升温至![]() ,再由
,再由![]() 突然降温至
突然降温至![]()
D.从![]() 无限缓慢升温至
无限缓慢升温至![]() ,再由
,再由![]() 突然降温至
突然降温至![]()
五、本题包括2小题,共16分
25.(8分)![]() 的硫酸溶液能恰好与
的硫酸溶液能恰好与![]() 盐酸羟胺(
盐酸羟胺(![]() )完全反应,
)完全反应,![]() 被还原成
被还原成![]() .用
.用![]()
![]() 溶液滴定所得溶液
溶液滴定所得溶液![]() 全部转化为
全部转化为![]() ,消耗了
,消耗了![]() 溶液.
溶液.
(1)写出用![]() 溶液滴定时的离子方程式;
溶液滴定时的离子方程式;
(2)写出盐酸羟胺与![]() 反应的化学方程式.
反应的化学方程式.
26.(8分)在已平衡的托盘天平左右托盘上各放一等质量的烧杯,并分别往烧杯中注入5 mol/L盐酸60 mL.向左盘烧杯中放入![]() 粉末,往右盘烧杯中加入x g A物质粉末,充分反应后天平仍保持平衡.
粉末,往右盘烧杯中加入x g A物质粉末,充分反应后天平仍保持平衡.
(1)若A为![]() .
.
①当a≤15时,x的值为________(用含a的代数式表示,以下同).
②当18.6≥a>15时,x的值为________.
③当a>18.6时,x的值为________.
(2)若A为![]() ,且两只烧杯中均无固态物质存在,则x的取值必须满足的条件是________.
,且两只烧杯中均无固态物质存在,则x的取值必须满足的条件是________.
六、本题包括2小题,共16分
27.(8分)将a mol的![]() 和
和![]() 固体混合后,在密闭容器中加热到250℃,让其充分反应,假设
固体混合后,在密闭容器中加热到250℃,让其充分反应,假设![]() 分解产生的
分解产生的![]() 与
与![]() 反应完后,
反应完后,![]() 再与
再与![]() 反应.
反应.
(1)当剩余固体为![]() ,排出气体为
,排出气体为![]() ,
,![]() 时,
时,![]() 的值为________.
的值为________.
(2)当剩余固体为![]() ,NaOH,排出气体为
,NaOH,排出气体为![]() ,
,![]() 时,
时,![]() 的值为________.
的值为________.
(3)当![]() 时,剩余固体为________,排出气体为________.
时,剩余固体为________,排出气体为________.
(4)当排出的![]() 和
和![]() 为等物质的量时,则
为等物质的量时,则![]() 的值为________.
的值为________.
28.(8分)将固体草酸锰![]() 放在一个可以称出质量的容器里加热.固体质量随温度的变化的关系如下图所示:
放在一个可以称出质量的容器里加热.固体质量随温度的变化的关系如下图所示:
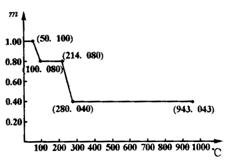
试通过对该图象数据分析和计算,回答在不同温度范围固体质量变化的原因.
七、本题包括2小题,共19分
29.(9分)节日期间所使用的大型气球,通常用钢瓶中装铝和氢氧化钠溶液混合产生的氢气来充灌.现要制作某一气球,假定它是一个标准圆球,其球的直径为X dm;气球材料的弹性极大,其质量为n kg.现提供铝片Y mol,足量的浓度为a mol/L的氢氧化钠溶液.若要使此气球能升到空中,试确定Y与X的关系.(已知:空气的密度为![]() ,其单位为g/L,且假定
,其单位为g/L,且假定![]() 在一定的空中范围内为不变量.)
在一定的空中范围内为不变量.)
30.(10分)著名的“侯氏制碱法”第一步反应是向饱和氨化盐水中通入二氧化碳,该反应可表示为![]()
有关物质的溶解度数据如下(g/100g水):
NaCl ![]()
![]()
10℃ 35.8 8.15 33.0
45℃ 37.0 14.0 50.0
现在45℃时,向434 g饱和食盐水中通入适量氨气,再向其中通入二氧化碳后,按上述反应进行完全.试计算并回答下列问题(计算结果保留三位有效数字).
(1)反应完全后45℃时析出的晶体的化学式是________,并计算析出晶体的质量.
(2)过滤除去晶体后再降温至10℃,此时析出的晶体是(填化学式)________,计算所析出晶体的质量.
参考答案
1.D 2.B 3.B 4.D 5.A 6.AD 7.D 8.AD 9.A 10.AC 11.AC
12.D 13.BC 14.D 15.C 16.D 17.A 18.B 19.A 20.A 21.C 22.D
23.(1)CuS、S (2)6∶1∶4
(3)![]()
![]()
24.(1)D (2)> (3)B
25.解析:(1)![]()
(2)因![]() 中的
中的![]() ,
,![]() 中的
中的![]() ,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即
,故依电子得失守恒有(x+1)×25.00×0.1000=5×30.00×0.0500,解之,x+2,即![]() 被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故
被氧化成+2价氮的氧化物NO.又因V×C×2=30.00×0.0500×5,故![]() .依题意知,
.依题意知,![]()
![]()
![]()
![]() .所以
.所以![]() 与
与![]() 反应的方程式为
反应的方程式为![]()
![]()
26.解析:这是一道天平平衡问题的计算.两个烧杯的质量相等.两个烧杯里盐酸溶液的质量相等.因此论证天平两个烧杯内反应体系质量改变量相等是解决本题的关键.由题意可知:
![]() 溶液增重
溶液增重
100 56
a 0.56a
![]() 溶液增重
溶液增重
84 40
x 40x/84
当0.3 mol HCl与![]() 恰好完全反应时,消耗
恰好完全反应时,消耗![]() 的质量为:
的质量为:![]() 时;0.3 mol HCl与
时;0.3 mol HCl与![]() 恰好完全反应,消耗
恰好完全反应,消耗![]() 的质量为:0.3×84=25.2 g
的质量为:0.3×84=25.2 g
(1)a≤15 g时,盐酸对于![]() 、
、![]() 均过量,天平保持平衡的条件是:
均过量,天平保持平衡的条件是:
![]() x=1.176a
x=1.176a
(2)a>15 g时,盐酸对于![]() 不足,且对于
不足,且对于![]() 恰好完全反应时,加入
恰好完全反应时,加入![]() 的烧杯内反应体系的增重量为a-0.15×44,而加入
的烧杯内反应体系的增重量为a-0.15×44,而加入![]() 的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
的烧杯内反应体系的增重量为0.3×40.则天平保持平衡的条件是:
a-0.15×44=0.3×40 a=18.6
因此,18.6≥a>15时,天平保持平衡的条件是:
![]() x=2,1a-13.86
x=2,1a-13.86
(3)当a>18.6时,天平保持平衡的条件是:a-0.15×44=x-0.3×44
x=a+6.6
因为烧杯中无固体剩余,说明a≤15.![]() 、
、![]() 的摩尔质量相当,当等质量的
的摩尔质量相当,当等质量的![]() 、
、![]() 与酸完全反应时,生成
与酸完全反应时,生成![]() 质量相等.所以天平保持平衡时:x=a≤15
质量相等.所以天平保持平衡时:x=a≤15
27.解析:题中涉及化学反应如下:
![]() ①
①
![]() ②
②
![]() ③
③
(1)当剩余固体为![]() ,排出气体为
,排出气体为![]() 、
、![]() 时,因为没有NaOH生成,水未与
时,因为没有NaOH生成,水未与![]() 反应.将方程式①×2+②得:
反应.将方程式①×2+②得:![]()
![]()
由方程式可知:![]() .
.
(2)当剩余固体为![]() 、NaOH,排出气体为
、NaOH,排出气体为![]() 、
、![]() 时,由于有NaOH生成,所以有水与
时,由于有NaOH生成,所以有水与![]() 反应.假设反应后无
反应.假设反应后无![]() 生成,将方程式①×2+②+③得:
生成,将方程式①×2+②+③得:
![]()
由方程式可知此时![]() .因为有水生成,所以
.因为有水生成,所以![]()
(3)当![]() 时,由2讨论可知:剩余固体为
时,由2讨论可知:剩余固体为![]() 、NaOH、
、NaOH、![]() ;排出气体为
;排出气体为![]() .
.
(4)当排出的![]() 和
和![]() 为等物质的量时,依方程式讨论有:
为等物质的量时,依方程式讨论有:
![]()
2b b b
![]()
b b ![]()
设反应的![]() 的物质的量为x
的物质的量为x
![]()
x x ![]()
依题意有:![]()
![]()
所以,反应中消耗![]() 的物质的量为:
的物质的量为:![]() ,用去
,用去![]() 的物质的量为:
的物质的量为:![]()
所以,
28.(1)0~50℃时,![]() 不发生分解,固体物质质量不变
不发生分解,固体物质质量不变
(2)50℃~100℃时,固体质量由1.00 g减至0.80 g,这是![]() 分解的结果,结晶水全部失去
分解的结果,结晶水全部失去
![]()
179 143
![]()
(3)100℃~214℃时,![]() 稳定且不发生分解,故固体质量不变
稳定且不发生分解,故固体质量不变
(4)214℃~280℃时,固体质量由0.80 g减至0.40 g,说明![]() 发生了分解
发生了分解
![]()
143 55+16x
0.80 0.40
x≈1 y=1.5,
故反应方程式为![]()
(5)280℃~943℃时,固体质量由0.40增至0.43
g,这是MnO与![]() 反应生成高价态氧化物
反应生成高价态氧化物![]()
 方程式为
方程式为![]()
![]()
29.解:假设反应后的混合物标况下仍为气体且体积为![]() ,由
,由![]() ,得
,得![]()
![]() ,可见反应前后物质的量不变,设烷烃为
,可见反应前后物质的量不变,设烷烃为![]() ,体积为x,则CO为1 L-x
,体积为x,则CO为1 L-x
由![]() 体积减少
体积减少
2 L 1 L 2 L 1 L
1 L-x ![]()
![]() 体积增加
体积增加
1 L ![]() nL (n+1)L
nL (n+1)L ![]()
x ![]()
据题意得:![]() nx=1L
nx=1L
讨论:(1)n=l时,x=1 L不合题意
(2)n=2时,![]()
(3)n=3时,![]()
(4)n=4时,![]()
(5)n≥5时,常温下烷烃不是气态,所以,烷烃可能是![]() 占50%或是:
占50%或是:![]() 占33.3%或:
占33.3%或:![]() 占25%
占25%
30.(1)![]()
45℃时434 g饱和食盐水中
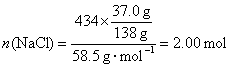
![]()
2 mol 2 mol 2 mol 2 mol
溶液中剩余的水的质量为:![]()
析出小苏打的质量为:![]()
(2)![]() 和
和![]()
当降温至10℃时,析出![]() 的质量为:
的质量为:
![]()
析出![]() 的质量为:
的质量为:
![]() 共析出晶体的质量为:14.3 g+16.4 g=30.7 g
共析出晶体的质量为:14.3 g+16.4 g=30.7 g