高考热点专题测试卷:专题五 无机推断题
说明:本试卷共分两卷,第Ⅰ卷为选择题,把正确答案序号填在题后答题卡内.第Ⅱ卷为非选择题,直接在本卷内作答.
第Ⅰ卷(共83分)
一、选择题:每小题3分,5小题共15分.每小题只有一个选项正确.把正确选项的代号填在题后答题卡中.
1.1995年美国教授Lagow报道,他制得了碳的第四种同素异形体——链式炔碳:
![]() 该物质的一个分子中含300-500个碳原子,性质很活泼.据此判断链式炔碳的熔点,估计比石墨( )
该物质的一个分子中含300-500个碳原子,性质很活泼.据此判断链式炔碳的熔点,估计比石墨( )
A.高 B.低 C.相等 D.无法判断
2.过氧化氢与硫酸酸化的高锰酸钾溶液进行反应生成硫酸钾、硫酸锰、水和氧气.如果过氧化氢中的氧原子是示踪原子(![]() ),当反应完全后,含有示踪原子的物质是( )
),当反应完全后,含有示踪原子的物质是( )
A.硫酸钾 B.硫酸锰 C.氧气 D.水
3.在含有不同离子的四种溶液中,加过量盐酸得到了白色沉淀,过滤,在滤液中加过量氨水又得到白色沉淀,过滤,在滤液中加入![]() 溶液仍得到白色沉淀的是( )
溶液仍得到白色沉淀的是( )
A.![]() 、
、![]() 、
、![]() B.
B.![]() 、
、![]() 、
、![]()
C.![]() 、
、![]() 、
、![]() D.
D.![]() 、
、![]() 、
、![]()
4.欲同时对农作物施用含N、P、K三种元素的化肥,现有:( )
①![]() ②KCl ③
②KCl ③![]() ④
④![]() ⑤氨水,最适合的组合是
⑤氨水,最适合的组合是
A.①③④ B.②③④ C.①③⑤ D.②③⑤
5.下列各组物质中,两者互为同分异构体的是( )
①![]()
②![]()
③![]()
④![]() 与
与![]()
A.①②③ B.②③④ C.②③ D.③④
二、选择题:本题包括8小题,每小题4分,共32分.每小题有一个或二个选项符合题意.若正确答案只包括一个选项,多选时,该题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给4分,但只要选错一个,该题就为0分.把正确选项的代号填在题后答题卡中.
6.右图示为白磷在空气中充分燃烧后,生成物分子的结构示意图.其中圆圈表示原子,实线表示化学键.下列关于该生成物的叙述中不正确的是( )

A.生成物的化学式为![]()
B.分子中磷原子排列成正四面体型
C.单实线表示的化学键为极性键,双实线表示的为非极性键
D.分子中每个磷原子都处于一个正四面体的中心
7.最近,科学家冶炼出了纯度高达99.9999%的铁,你估计它不会具有的性质是( )
A.硬度比生铁低
B.在潮湿的空气中放置不易生锈
C.与![]() 盐酸的反应速率比生铁快
盐酸的反应速率比生铁快
D.在冷的浓![]() 中可钝化
中可钝化
8.某白色固体可能由①![]() ②
②![]() ③NaCl ④
③NaCl ④![]() ⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀生成.对原固体的判断不正确的是( )
⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀生成.对原固体的判断不正确的是( )
A.肯定存在① B.至少存在②和⑤
C.无法确定是否有③ D.至少存在①、④、⑤
9.市场上销售的“84”消毒液,其商品标识上有如下叙述:
①本品为无色液体,呈碱性 ②使用时加水稀释 ③可对餐具、衣物进行消毒,可漂白浅色衣物.其有效成分可能是( )
A.![]() B.
B.![]() C.NaClO D.
C.NaClO D.![]()
10.某溶液中加入过量稀![]() 后,有S和
后,有S和![]() 生成,则原溶液中可能含有:( )
生成,则原溶液中可能含有:( )
A.![]()
B.![]() 和
和![]() 且物质的量比值小于
且物质的量比值小于![]()
C.![]() 和
和![]() 且物质的量比值大于
且物质的量比值大于![]()
D.![]() 和
和![]() 且物质的量比值小于
且物质的量比值小于![]()
11.在一种酸性溶液中可能存在![]() 、
、![]() 、
、![]() 、
、![]() 中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
中的一种或几种离子,向该溶液中加入溴水,溴单质被还原,由此可推断溶液中( )
A.一定含有![]() ,不能确定是否含有
,不能确定是否含有![]()
B.可能含有![]() 、
、![]() 和
和![]()
C.可能含有![]()
D.不含有![]()
12.向明矾溶液中滴入![]() 溶液,当
溶液,当![]() 恰好沉淀完全时,铝元素主要存在形式是( )
恰好沉淀完全时,铝元素主要存在形式是( )
A.![]() 和
和![]() ,且
,且![]() 较多
较多
B.![]() 和
和![]() ,且
,且![]() 较多
较多
C.![]() 和
和![]() 且
且![]() 较多
较多
D.![]() 和
和![]() 且
且![]() 较多
较多
13.下列分子结构中,原子最外层电子不能都满足8电子结构的是( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
三、选择题:本题包括9个小题,每小题4分,共36分.每小题只有一个选项符合题意.把正确选项的代号填在题后答题卡中.
14.硫酸铜晶体(![]() )在t℃时可部分失水得到
)在t℃时可部分失水得到![]() 和
和![]() 现将一定质量硫酸铜晶体,加热到t ℃一段时间后,冷却、称量,质量减轻21.6%.若所得固体只由两种成分组成,则这两种成分不可能的一组是( )
现将一定质量硫酸铜晶体,加热到t ℃一段时间后,冷却、称量,质量减轻21.6%.若所得固体只由两种成分组成,则这两种成分不可能的一组是( )
A.![]() ;
;![]()
B.![]() ;
;![]()
C.![]() ;
;![]()
D.![]() ;
;![]()
15.某氮的气态氧化物15.6L和过量的氢气混合,在一定条件下反应,使之生成液态水及无公害气体,恢复到原状态,反应后气体体积比反应前气体体积缩小了46.8 L,则原氮的氧化物的化学式为( )
A.![]() B.
B.![]() C.NO D.
C.NO D.![]()
16.已知反应:![]() ,把
,把![]() 、
、![]() 、
、![]() 、CuS和AgI的混合物按加入试剂的先后顺序,将其逐一溶解,最适宜的一组试剂是( )
、CuS和AgI的混合物按加入试剂的先后顺序,将其逐一溶解,最适宜的一组试剂是( )
A.![]() 、
、![]() 溶液、盐酸、氨水、硝酸
溶液、盐酸、氨水、硝酸
B.氨水、![]() 溶液、稀硫酸、稀硝酸、KCN溶液
溶液、稀硫酸、稀硝酸、KCN溶液
C.![]() 溶液、稀硫酸、KCN溶液、NaOH溶液、氨水
溶液、稀硫酸、KCN溶液、NaOH溶液、氨水
D.![]() 、NaOH溶液、盐酸、KCN溶液、硝酸
、NaOH溶液、盐酸、KCN溶液、硝酸
17.在下图的甲、乙两个装置的烧瓶中盛有同一种红棕色气体M,用弹簧夹夹住橡皮管,烧杯中盛有水.向甲烧杯中加入X,甲烧瓶中气体颜色变浅;向乙烧杯中加入Y,乙烧瓶中气体颜色变深;下列关于气体M与X、Y的组合正确的是( )
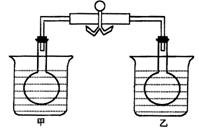
| A | B | C | D | |
| M |
|
|
|
|
| X | NaOH固体 | 硝铵固体 | 冰块 | 碱石灰 |
| Y | 无水乙醇 | 生石灰 | 浓硫酸 | 醋酸铵 |
18.为了实现我国政府在1997年12月31日前对淮河流域环境的治理,某甲、乙两相邻的工厂做了横向联合.已知两厂排放的污水经初步处理后,只溶有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的各不同的4种离子(设各离子浓度比较大),若单独排放仍会造成环境污染,如将两厂的污水按适当的比例混合,沉淀后污水变成无色澄清的硝酸钠溶液排出,则污染程度会大为降低.你认为下列分析判断正确的是( )
中的各不同的4种离子(设各离子浓度比较大),若单独排放仍会造成环境污染,如将两厂的污水按适当的比例混合,沉淀后污水变成无色澄清的硝酸钠溶液排出,则污染程度会大为降低.你认为下列分析判断正确的是( )
A.![]() 和
和![]() 可存在于一工厂
可存在于一工厂
B.![]() 和
和![]() 一定在不同的工厂
一定在不同的工厂
C.![]() 和
和![]() 可能在同一工厂
可能在同一工厂
D.![]() 和
和![]() 来自同一工厂
来自同一工厂
19.有一种混合气体,它可能由CO、![]() 、
、![]() 、HCl中的一种或多种气体组成.该气体依次通过下列物质的现象如下:通过澄清石灰水无白色沉淀析出;通过品红溶液,溶液红色褪去;通过炽热的CuO,固体变为红色;通过澄清石灰水,出现白色沉淀.该混合气体组成的各说法中,正确的是( )
、HCl中的一种或多种气体组成.该气体依次通过下列物质的现象如下:通过澄清石灰水无白色沉淀析出;通过品红溶液,溶液红色褪去;通过炽热的CuO,固体变为红色;通过澄清石灰水,出现白色沉淀.该混合气体组成的各说法中,正确的是( )
A.肯定不含有![]()
B.只含有![]() 和CO
和CO
C.含有![]() 、CO和
、CO和![]() ,可能含HCl
,可能含HCl
D.含HCl、![]() 和CO,可能含
和CO,可能含![]()
20.某铁的氧化物,用7 mol/L的盐酸100 mL在一定条件下恰好完全溶解,所得溶液再通入0.56 L标准状况下的氯气时,刚好使溶液中![]() 完全转化为
完全转化为![]() .则该氧化物的化学式可表示为( )
.则该氧化物的化学式可表示为( )
A.FeO B.![]() C.
C.![]() D.
D.![]()
21.有A、B、C三种气体分别是![]() 、HCl、HI中的一种,但不知道它们具体是什么气体.将A、B混合不反应,则下面正确的判断是( )
、HCl、HI中的一种,但不知道它们具体是什么气体.将A、B混合不反应,则下面正确的判断是( )
A.A、B能确定 B.C肯定不是HCl
C.C可能是HCl D.C不是![]() 也不是HI
也不是HI
22.某种混合气体,可能含有![]() 、HCl、CO.把混合气体依次通过足量的
、HCl、CO.把混合气体依次通过足量的![]() 溶液的灼热CuO,气体体积都没有变化.再通过足量的
溶液的灼热CuO,气体体积都没有变化.再通过足量的![]() 固体,气体体积减小.最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体.以下对混合气体组分的判断,正确的是( )
固体,气体体积减小.最后通过灼热的铜网,经充分反应后气体体积又减小,但还有剩余气体.以下对混合气体组分的判断,正确的是( )
A.一定没有![]() ;CO和HCl中至少有一种
;CO和HCl中至少有一种
B.一定有![]() 、HCl和CO
、HCl和CO
C.一定有![]() ;CO和HCl中至少有一种
;CO和HCl中至少有一种
D.一定有![]() 和HCl;没有CO
和HCl;没有CO
答题卡
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
| 分值 | 3分 | 3分 | 3分 | 3分 | 3分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 | |||||||||||
| 题号 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 |
| 分值 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 | 4分 |
| 选项 |
第Ⅱ卷(共67分)
四、本题包括2小题共13分
23.(6分)贮气袋中存有有色气体,可能是![]() 、
、![]() 、
、![]() 、HCl、
、HCl、![]() 、
、![]() 蒸气等气体中的几种,进行以下操作:①通少许于水中,得无色溶液;②通少许于
蒸气等气体中的几种,进行以下操作:①通少许于水中,得无色溶液;②通少许于![]() 溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶中,导出的气体再通入澄清石灰水,产生浑浊.则:由①可判断,一定存在_________;一定不存在________.由②可判断,一定存在_________;一定不存在_________.由③、④可判断,一定存在________;可能存在的是________.
溶液中,有沉淀产生;③通少许于澄清石灰水中,无浑浊现象;④通过装有水的洗气瓶中,导出的气体再通入澄清石灰水,产生浑浊.则:由①可判断,一定存在_________;一定不存在________.由②可判断,一定存在_________;一定不存在_________.由③、④可判断,一定存在________;可能存在的是________.
24.(7分)某河道两旁有甲乙两厂.它们排放的工业废水中,共含![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 六种离子.
六种离子.
(1)甲厂的废水明显呈碱性,故甲厂废水中所含的三种离子是________、_________、________.
(2)乙厂的废水中含有另外三种离子.如果加一定量_______________(选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属_______________(填写金属元素符号).
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的________
_________(填写离子符号)转为沉淀.经过滤后的废水主要含__________________,可用来浇灌农田.
五、本题包括2小题共20分
25.(7分)下列关系图中,A是一种正盐,D的式量比C大16,E是酸.当X无论是强酸还是强碱时都有如下转化关系:
![]()
当X是强酸时,A、B、C、D、E均含有同一种元素;当X是强碱时,A、B、C、D、E均含有另一种元素
回答下列问题(用化学式填写):
(1)A是________________,Y是_______________,Z是________________.
(2)当X是强碱时,E是________________.
(3)当X是强酸时,E是________________.
(4)写出A与X反应的离子方程式_______________.
26.(13分)合金A由4种单质组成,经过一系列反应分别进入了沉淀或气体中.

试回答:
(1)合金A由哪4种元素的单质组成?_________、________、________、_________.
(2)写出固体B、溶液C、沉淀D和气体E、F有关组成的化学式:
B_________、C_________、D_________、E_________、F_________.
(3)写出合金A中的有关组成与过量烧碱溶液反应生成无色气体E的化学反应方程式:
__________________________________________________________________________.
(4)写出向无色溶液C加适量盐酸生成白色沉淀D有关反应的离子方程式:
__________________________________________________________________________.
六、本题包括2小题共15分
27.(6分)下列物质存在如图所示的转化.

(1)当X为两种非金属元素所组成的化合物时,则下列物质的化学式为
甲______________,乙_______________,
丙______________;X______________,
Y_______________,Z_______________.
(2)当X为金属元素与非金属元素所组成的化合物时,则下列物质的化学式为
甲_______________,乙_______________丙______________;X_______________,Y______________,Z______________.
28.(9分)硫酸钡是惟一无毒的钡盐,工业上以![]() 等为原料通入下列流程反应可以制备锌钡白和过氧化氢:
等为原料通入下列流程反应可以制备锌钡白和过氧化氢:
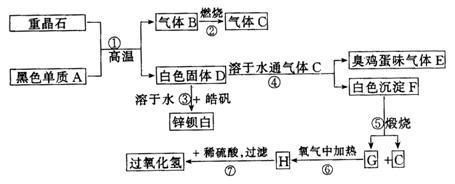
(1)上述流程中共有7个化学反应,其中有_________个属于氧化还原反应.
(2)写出过氧化氢的电子式_____________.写出物质H的电子式_____________.
(3)写出下列化学反应方程式:
反应①:___________________________________________________________________.
反应③:___________________________________________________________________.
反应④:___________________________________________________________________.
反应⑦:___________________________________________________________________.
七、本题包括2小题共19分
29.(8分)有A、B两种无机含氧酸的正盐,A盐中的阳离子为+2价,B盐中的阳离子为+1价.现把两盐的浓溶液混合使其发生复分解反应,完全作用后产生带+2价阳离子的沉淀C及含溶质D的滤液.取5.00 g沉淀C在高温下灼烧可得2.80 g固态的金属氧化物E,并生成了能使澄清石灰水变浑浊的无色刺激性气味的气体F.1 mol固体D受热分解,生成1 mol气态非金属氧化物G和![]() (气)组成的混合气体,混合气体的密度是
(气)组成的混合气体,混合气体的密度是![]() 的
的![]() 倍.请回答:
倍.请回答:
(1气体F的化学式是________________;
(2)列式计算确定金属氧化物E的化学式
(3)列式计算确定非金属氧化物G的化学式
(4)A的化学式是_________________,B的化学式是________________.
30.(11分)某复盐的组成可表示为:![]() ,R为-2价含氧酸根.为了确定该盐的组成,进行如下实验:
,R为-2价含氧酸根.为了确定该盐的组成,进行如下实验:
(1)准确称取4.02 g样品加热到失去全部结晶水,冷却后称量,质量为2.94 g.
(2)将剩余固体溶于适量水,滴加盐酸,无现象,再滴加足量![]() 溶液,产生白色沉淀.过滤,将沉淀烘干,称质量为4.66 g.
溶液,产生白色沉淀.过滤,将沉淀烘干,称质量为4.66 g.
(3)向上述溶液中加入过量NaOH溶液,产生白色沉淀,过滤,将沉淀烘干,称质量为0.58g,再将固体高温灼烧后冷却,称得剩余固体质量是0.40 g.
请通过计算回答下列问题:
(1)确定R的化学式. R的化学式______________.
(2)求x、y、z的值. x=________,y=________,z=_________.
(3)确定A是什么元素. A元素的名称是_____________.
(4)该复盐的化学式为______________.
(5)要确定某化合物是否含A元素,最简单方法是______________.
参考答案
1.B 2.C 3.C 4.B 5.B 6.C 7.C 8.B 9.C 10.AC 11.AD 12.D
13.B 14.A 15.B 16.D 17.B 18.B 19.D 20.D 21.C 22.C
23.(1)![]() ;
;![]() ;(2)HCl;
;(2)HCl;![]() ;(3)HCl、
;(3)HCl、![]() 、
、![]()
24.(1)![]() 、
、![]() 、
、![]() ;(2)铁粉,Ag
;(2)铁粉,Ag
(3)![]() 、
、![]() 、
、![]() 、
、![]() ;
;![]()
25.D的式量比C大16,猜想Y是![]() .
.![]() 的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
的连锁反应中,中心元素的价态接连升高,且可能出现一种这样的中心元素,猜想中心元素是硫或氮.
正盐A既能与强酸反应,又能跟强碱反应,且生成硫或氮的化合物,说明A是弱酸的铵盐![]()
(1)![]()
![]()
![]()
(2)![]() (3)
(3)![]()
(4)![]() 或
或![]()
26.(1)Fe、C、Si、Al
(2)Fe、C ![]() 、
、![]()
![]() 、
、![]()
![]() 、
、![]()
(3)![]()
(4)![]()
![]()
27.(1)Mg ![]() C
C ![]() MgO CO
MgO CO
(2)![]() Fe
Fe ![]()
![]()
![]()
![]()
28.(1)3
(2)![]()
(3)![]() ,
,![]()
![]()
![]() ,
,![]()
29.(1)![]() (2)设金属元素的原子量为x
(2)设金属元素的原子量为x
![]()
5.00 g 2.80 g 2.20 g
x+16 44
![]() x=40,该金属元素是Ca,氧化物E的化学式是CaO
x=40,该金属元素是Ca,氧化物E的化学式是CaO
(3)![]() ,设G的分子量为y,则
,设G的分子量为y,则![]() ,y=44,若G
,y=44,若G
分子中含有1个O原子,则44-16=28,28是N原子量的2倍,则G是![]() ,若G分子中含2个O原子,则44-32=12,则G是
,若G分子中含2个O原子,则44-32=12,则G是![]() ,不合题意
,不合题意
(4)![]() ,
,![]()
30.(1)由于向溶液中滴加盐酸,无现象,再滴加![]() 溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为
溶液,产生白色沉淀.所以,R必定是硫酸根;R的化学式为![]()
(2)4.02 g样品中含结晶水的物质的量为![]()
4.02 g样品中含硫酸根的物质的量为![]()
![]()
![]()
b+34 18 18
0.58 g (0.58-0.40)g
解得 b=24,∴ B是镁元素
4.02 g样品中含硫酸镁的物质的量为![]()
4.02 g样品中含另一种硫酸盐的物质的量为0.02 mol-0.01 mol=0.01 mol
x∶y∶z=0.01∶0.01∶0.06=l∶1∶6
∴ x=1;y=1;z=6
(3)A的原子量为![]() ,∴ A是钾元素
,∴ A是钾元素
A元素的名称是钾
(4)复盐的化学式为![]()
(5)焰色反应