高考化学课前选择题练习(15)
2008年4月1日 编辑:熊维平
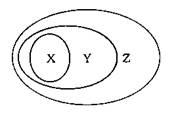
1.用右图表示的一些物质或概念之间的从属或包含关系中不正确的是
| X | Y |
| |||
| 例 | 氧化物 | 化合物 | 纯净物 | ||
| A | 苯 | 芳香烃 | 有机化合物 | ||
| B | 溶液 | 分散系 | 混合物 | ||
| C | 强电解质 | 电解质 | 化合物 | ||
| D | 置换反应 | 氧化还原反应 | 离子反应 |
2.若NA表示阿伏加德罗常数的值,下列说法正确的是
A.2.3g Na在足量的O2中完全燃烧和与在空气中缓慢反应完全,转移的电子数均为0.1NA
B.11.2L Cl2所含的原子数为NA
C.化学上定义12g 碳中的碳原子数为NA的数值
‥
D.17g .O︰H中所含电子数为7NA
‥
3.下列实验操作和事故处理中,正确的是
A.银镜反应实验后附有银的试管,可用稀硫酸洗涤
B.在中学“硫酸铜晶体中结晶水含量测定”的实验中称量操作致少需要四次
C.不慎将浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗
D.在250mL烧杯中,加入216mL水和24gNaOH固体,配制10%NaOH溶液
4.由两种短周期元素A和M形成的离子化合物A2M3,A3+离子比M2-离子少一个电
子层,且A3+具有与Ne原子相同的核外电子层结构,则下列说法正确的是
A.化合物A2M3是三氧化二铝
B.A3+和M2-最外电子层上的电子数都是8
C.A的最高价氧化物对应的水化物是强电解质
D.元素M是第2周期第VIA族的元素
5.在加入铝粉产生氢气的溶液中,下列各组离子可能大量共存的是
A.NH![]() 、NO
、NO![]() 、CO
、CO![]() 、Na+
、Na+
B.Ba2+、Mg2+、HCO![]() 、Na+
、Na+
C.H+ 、F一、K+ 、Cl-
D.K+ 、AlO![]() 、OH一、NO
、OH一、NO![]()
6.某酸式盐NaHY的水溶液显碱性,下列叙述正确的是
![]() A.H2Y的电离方程式:H2Y 2H++Y2—
A.H2Y的电离方程式:H2Y 2H++Y2—
B.该酸式盐溶液中离子浓度关系:c(H+)+c(Na+)=c(OH—)+c(Y2—)+c(HY—)
C.该酸式盐溶液中离子浓度关系:c(H+)+ c(H2Y) =c(OH—)+c(Y2—)
D.该酸式盐溶液中离子浓度大小关系: c(Na+)> c(OH—)> c(H+)>c(HY—)
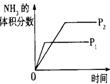
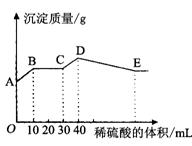 7.将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol·L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是
7.将氢氧化钠、氯化钡和硫酸铝三种固体组成的混合物溶于足量的水中,充分溶解,用1mol·L-1稀硫酸滴定,加入稀硫酸的体积与生成沉淀的质量关系如图所示。下列有关判断正确的是
A.A点所表示的沉淀的化学式是: Al(OH)3、 BaSO4
B.B~C段所发生反应的离子方程式是:H+ + OH- = H2O
C.A~B段所发生反应的离子方程式是:Ba2+ + SO42- =BaSO4↓
D.E点所表示的溶液中:n (Na+) = n (Cl-)
8.已知:H2O(g)=H2O(l); △H1= —Q1kJ·mol—1
CH3OH(g)=CH3OH(l); △H2= —Q2kJ·mol—1
2CH3OH(g)+3O2 = 2CO2(g)+4H2O(g); △H3= —Q3kJ·mol—1(Q1,Q2,Q3均大于0)
若要使32g液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)
A.Q1+Q2+Q3
B.0.5Q3—Q2+2Q1
C.0.5Q3+Q2—2Q1
D.0.5(Q1+Q2+Q3)
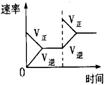
9.对于可逆反应N2(g)+3H2(g)![]() 2NH3(g);△H<0,下列研究目的和示意图相符的是
2NH3(g);△H<0,下列研究目的和示意图相符的是
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 |
|
|
|
|
10.把一定量的NaHCO3和Na2O2的混合物放在密闭容器中加热。关于混合物加热前后消耗盐酸的物质的量,下列结论判断正确的是
A.加热前消耗的多
B.加热后消耗的多
C.加热前加热后消耗的一样多
D.不知NaHCO3和Na2O2含量无法确定
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 姓名 |
| 答案 |
|
|
|
|
|
|
|
|
|
|
|