石门中学2004-2005学年度第一学期高一年级化学科
中段考试题
注意:①全卷共7页,供1-18班使用。考试时间为90分钟
②全卷分第一卷和第二卷,其中第一卷占60%,第二卷占40%。
③解题可能需要的原子量: H-1 C-12 N-14 O-16 Ne-20 S-32
Cu-64 Cl-35.5 Na-23 Mg-24 Al-27 Fe-56 Zn-65
第一卷
(第一卷答案填在答题卡上)
一、 选择题(下列1-20题每题仅一个正确选项,每题2分)
1. 下列操作不正确的是:
A. 用燃着的酒精灯去点燃另一盏酒精灯。
B. 熄灭酒精灯时,用灯帽盖灭。
C. 过滤操作中,必须用玻璃棒引流混合物。
D. 转移溶液入容量瓶时,必须用玻璃棒引流。
2. 下列混合物的分离方法不正确的是:
A. 沸点不同的液体可用蒸馏的方法分离。
B. 易溶与难溶的固体混合物可用溶解、过滤、蒸发、结晶的方法分离。
C. 用酒精可以从碘水中萃取碘。
D. 汽油和水的混合物可以用分液漏斗分离。
3. 下列实验操作中有错误的是:
A. 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出。
B. 蒸馏时,温度计水银球应浸没在液体中。
C. 蒸馏中,冷却水应从冷凝管的下口通入,上口流出。
D. 把几滴FeCl3饱和溶液滴入250mL的沸水中制取Fe(OH)3胶体。
4. 下列叙述正确的是:
A. 1摩尔氢为2克 B. H2O的摩尔质量为18克
C. 44克CO2的体积为22.4L D. 9.8克H2SO4含0.1NA个H2SO4分子
5. 1molSO2和1molSO3具有相同的:
①分子数 ②原子数 ③ S原子数 ④ O原子数
A. ①② B. ①③ C. ①④ D. ②④
6. 下列物质中,在标准状况下,体积最大的是:
A. 180克H2O B. 4克氢气
C. 500mL 2mol/L的H2SO4和足量锌反应 D. 1molKMnO4加热完全分解生成的O2
7. 下列溶液中,氯离子浓度最大的是:
A. 100mL 1mol/L的NaCl溶液 B. 150mL 1mol/L的MgCl2溶液
C. 200mL 1mol/L的HCl溶液 D. 10mL 1mol/L的AlCl3溶液
8. NA为阿伏加德罗常数,对于1mol/L的硫酸溶液,下列叙述错误的是:
A. 1000mL溶液中,含2NA个H+。
B. 1000mL溶液中,含3NA个离子(H+、SO42-)。
C. 1000mL溶液中,加入足量Zn,可生成2NA个H2分子。
D. 1000mL溶液中,加入足量Zn,可生成NA个Zn2+。
9. 下列物质中含原子数最多的是:
A. 0.5molNH3 B.8克CH4 C. 标准状况下22.4LH2 D. 20克氖
10. 体积相同的NaCl、MgCl2、AlCl3溶液,沉淀其中的Cl-,消耗等量的AgNO3,三种溶液的物质的量浓度之比为:
A. 3∶2∶1 B. 1∶2∶3 C. 6∶3∶2 D. 2∶3∶6
11. 等体积0.2mol/L的BaCl2溶液和0.2mol/L的Na2SO4溶液相混和(设体积为二溶液之和),下列叙述错误的是:
A. Ba2+和SO42-恰好完全反应 B. 出现白色沉淀
C. 混和液中c(Cl-)> c(Na+) D. 混和液中c(Na+)=c(Cl-)
12. 下列分散系属于胶体的是:
A. FeCl3溶液 B. CuSO4溶液 C. 碘酒 D. 有色玻璃
13. 属于电解质的是:
A. 硫酸溶液 B. 铜 C. NaCl D. CO2
14. 既是离子反应,又属于氧化还原反应的是:
A. CaCO3+HCl- B. AgNO3+NaCl-
C. Fe+CuSO4- D. H2SO4+NaOH-
15. 下列关于反应类型关系正确的是:
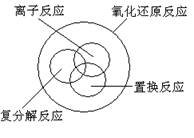
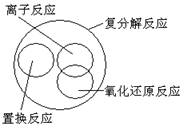
A. B.
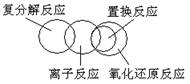
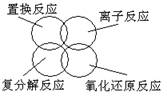
C. D.
16. 可用H++OH-=H2O表示的化学反应是:
A. H2SO4+Ba(OH)2- B. CH3COOH+Fe(OH)3-
C. H2CO3+KOH- D. HCl+NaOH-
17. 在酸性溶液中,能大量共存的离子组是:
A. NH4+、Na+、CO32-、NO3- B. Ag+、Na+、NO3-、Cl-
C. Na+、K+、Cl-、SO42- D. K+、Na+、NO3-、OH-
18. 能大量共存且溶液是无色的离子组合是:
A. H+、Na+、CO32-、MnO4- B. Cu2+、K+、NO3-、SO42-
C. K+、H+、NO3-、OH- D. Mg2+、Ca2+、Cl-、NO3-
19. 除去下列溶液中的杂质(括号内为杂质),选择试剂不正确的是:
A. HNO3【HCl】-用AgNO3
B. NaOH【Ba(OH)2】-用Na2SO4
C. NaCl【Na2SO4】-用Ba(NO3)2
D. KOH【K2CO3】-用Ca(OH)2
20. 用硫酸酸化的三氧化铬(CrO3)遇酒精后,其颜色由红变为蓝绿色,用这种现象可测得司机是否是酒后驾车.反应如下:
2CrO3 + 3C2H5OH + 3H2SO4 = Cr2(SO4)3 + 3CH3CHO + 6H2O
此反应的还原剂是:
A. H2SO4 B. CrO3 C.Cr2(SO4)3 D.C2H50H
二、 选择题(下列21-25题每题都有一个或二个正确选项,每题4分;若有两个正确选项,漏选一项得2分;若错选不得分)
21. 哪种物质能和另外三种物质发生离子反应:
A. HCl B. NaOH C. Na2CO3 D. Fe
22. 下列反应中,水既不是氧化剂,又不是还原剂的是:
A. 2Na+2H2O=2NaOH+H2↑ B. 2F2+2H2O=4HF+O2
C. NaH+H2O=NaOH+H2↑ D. Cl2+H2O=HCl+HClO
23. 下列离子方程式正确的是:
A. 碳酸钙加入盐酸中: CaCO3+2H+=Ca2++CO2↑+H2O
B. 铁片加入CuSO4溶液中: 2Fe+3Cu2+=3Cu+2Fe3+
C. 稀硫酸加入氢氧化钡溶液 2H++SO42-+Ba2++2OH-=BaSO4↓+H2O
D. 氯化铜溶液中加入NaOH溶液:Cu2++OH-=Cu(OH)2↓
24. 下列叙述正确的是
A. 将5.85gNaCl晶体溶入100mL水中,制得0.1mol/L的NaCl溶液。
B. 将25g无水CuSO4溶于水制成100mL溶液,其浓度为1mol/L。
C. 将wg a%的NaCl溶液蒸发掉![]() g水,得到2a%的NaCl溶液。
g水,得到2a%的NaCl溶液。
D. 将1体积c1mol/L的硫酸用水稀释为5体积,稀溶液的浓度为0.2c1mol/L
25. 下列哪种情况能使下图装置中的溶液导电性呈现“强-弱-强”变化的是:
A. 将50mL 0.1mol/L的H2SO4溶液慢慢加入50mL 0.1mol/L的Ba(OH)2溶液中; B. 将50mL 0.1mol/L的NaCl溶液慢慢加入50mL 0.1mol/L的AgNO3溶液中;
C. 在50mL 饱和澄清石灰水中通入CO2直至过量;
D. 在50mL 0.1mol/L的CH3COOH溶液中慢慢加入50mL 0.1mol/L的NaOH溶液
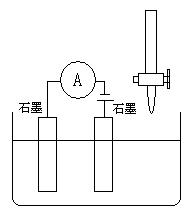
![]() 第二卷
第二卷
|
26.(3分)下列物质:①水 ②醋酸 ③盐酸 ④烧碱 ⑤硝酸钾 ⑥酒精 ⑦汽油 ⑧蔗糖
(用编号回答)其中属于弱电解质的有 ;属于强电解质的有 ;强电解质在水中 电离。
27.(4分)从金属锌、氢气、氧气、水、一氧化碳、氧化铜、盐酸中任意挑选作为反应物,按下列要求写出化学方程式:
①既属于化合反应,又属于氧化还原反应:
②属于氧化还原反应,不属于置换反应、化合反应、分解反应、复分解反应:
28.(9分)取少量Fe2O3粉末(红褐色)加入适量盐酸,发生的化学反应方程式为:
得到棕黄色的FeCl3溶液,用此溶液分别做如下实验。
① 取少量FeCl3溶液于试管,滴入几滴NaOH溶液,生成红褐色沉淀,发生的离子反应方程式为
② 在小烧杯中加入20mL蒸馏水,煮沸后,滴入几滴FeCl3溶液,继续煮沸至溶液呈红褐色,即制得______。用激光笔照射烧杯中的液体,可以观察到液体中
。这个实验可用于区别 。
③取少量FeCl3溶液,加入过量铁粉,溶液由棕黄色变成浅绿色,经检验生成了FeCl2。写出反应的离子方程式: 。
29.(2分)铜和浓H2SO4共热,发生如下反应:Cu+2H2SO4![]() CuSO4+SO2↑+2H2O。该反应中氧化剂与还原剂的物质的量之比为
,还原产物是
。
CuSO4+SO2↑+2H2O。该反应中氧化剂与还原剂的物质的量之比为
,还原产物是
。
30.(2分)正常人的血液中葡萄糖(简称血糖,分子式为C6H12O6)的浓度在3.61-6.11mmol/L之间,今测得某病人1mL血液中含葡萄糖0.60mg,相当于____mmol/L,血糖属正常、偏高还是偏低? 。
四、实验题(共9分)
31.今欲用NaOH晶体配制450mL 0.8mol/L的NaOH溶液。根据题意填空:
(1)配制该溶液应选用 mL容量瓶。
(2)用托盘天平称取 克固体NaOH。
(3)将称好的NaOH固体放至500mL的大烧杯中,倒入约300mL蒸馏水,用___搅拌至完全溶解。待 后,将烧杯中的溶液用玻璃棒引流转移至容量瓶中。
(4)用少量蒸馏水洗涤烧杯 次,洗涤液 轻轻晃动容量瓶,使溶液混和均匀。
(5)向容量瓶中加入蒸馏水,到液面 时,改用 加蒸馏水至液面与刻度线相切。盖好瓶塞 。
![]() 五、计算题(共11分)
五、计算题(共11分)
32.(1)实验室常用的浓盐酸密度为1.17g/mL、质量分数为36.5%。此浓盐酸的物质的量浓度为 mol/L。取此浓盐酸43mL,用蒸馏水稀释至200mL,稀盐酸的物质的量浓度为 mol/L。
(2)将4.8g镁投入此200mL稀盐酸中,反应后,求:
①放出的H2在标准状况下的体积。
②将生成的H2通过过量的灼热CuO,求被还原出的铜的质量。
③反应后(设溶液体积不变)溶液中两种阳离子的物质的量浓度之比。
石门中学2004-2005学年度第一学期高一年级化学科
中段考试题答案
第一卷
三、 选择题(下列1-20题每题仅一个正确选项,每题2分)
四、 选择题(下列21-25题每题都有一个或二个正确选项,每题4分;若有两个正确选项,漏选一项得2分;若错选不得分)
| 题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 |
| 答案 | A | C | B | D | B | B | D | C | B | C | C | D | C |
| 题号 | 14 | 15 | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 |
|
| 答案 | C | C | D | C | D | C | D | A | D | A | CD | C |
|
第二卷
三、填空(共20分)
26.(3分)①②;④⑤;完全(几乎完全;全部)。(每空1分,多写不给分,漏写扣0.5分)
27.(4分)①2H2+O2![]() 2H2O 或2Zn+O2
2H2O 或2Zn+O2![]() 2ZnO 或2CO+O2
2ZnO 或2CO+O2![]() 2CO2
2CO2
②CO+CuO![]() Cu+CO2 (每空2分,不写条件扣1分,没配平0分)
Cu+CO2 (每空2分,不写条件扣1分,没配平0分)
28.(9分)Fe2O3+6HCl=2FeCl3+3H2O(2分,没配平0分)
① Fe3++3OH-=Fe(OH)3↓(2分,没配平0分)
②Fe(OH)3胶体;有一条光亮的通路(或有光路、或有丁达尔效应、或有光效应);溶液和胶体。(每空1分)
③2Fe3++Fe=2Fe2+(2分,没配平/配错扣1分)
29.(2分)1∶1,SO2(二氧化硫)(每空1分)
30.(2分)3.33(或3.3) , 偏低 (每空1分)
四、实验题(共9分)(每空1分)
31.(1)500 (2)16.0 (3)玻璃棒 ,溶液冷却至室温
(4)2-3(2或3),转移入容量瓶
(5)离刻度线1-2cm,胶头滴管,上下翻动几次(摇匀)
五、计算题(共11分)
32.(1)11.7 , 2.52(或2.5或2.515)(每空1分)
(2) ①解: Mg + 2HCl = MgCl2 + H2↑ 1分
24g 2mol 1mol 22.4L
4.8g n(HCl) n(MgCl2) V(H2)
∵n(HCl)=0.4mol<0.2L×2.52mol/L
∴盐酸过量,以Mg的量计算 2分
V(H2)=4.48L 1分
n(MgCl2)= 0.2mol
②解:CuO + H2 ![]() Cu + H2O
1分
Cu + H2O
1分
22.4L 64g
4.48L m(Cu)
m(Cu)=12.8g 1分
③解:![]() 3分(若分别算出两种离子的物质的量或物质的量浓度得1分)
3分(若分别算出两种离子的物质的量或物质的量浓度得1分)
答:①放出的H2在标准状况下的体积为4.48L。
②被还原出铜的质量为12.8g
③反应后溶液中Mg2+和H+物质的量浓度之比为2∶1。