徐州市2005——2006学年度第一学期期末考试
高二化学试题(必修加选修)
本试卷分第一卷(选择题)和第二卷(非选择题)两部分。第一卷1页至4页,第二卷5页至10页。考试结束后,将本试卷和答题卡一并交回。考试时间120分钟。
第一卷(选择题 共74分)
注意事项:
1.答第一卷前,考生务必将自己的姓名、考试证号、考试科目用铅笔涂写在答题卡上。
2.第一卷答案必须填涂在答题卡上,在其它位置作答无效。每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干净后,再选涂其它答案。
可能用到的相对原子质量:H 1 C 12 N 14 O 16 C1 35.5 Na 23 Cu 64
一、选择题(本题包括8小题。每小题4分,共32分。每小题只有一个选项符合题意)
1. 据报道,科学家已成功合成了少量N4,有关N4的说法正确的是
A. N4与N2性质相同 B. N4是N2的同分异构体
C. 相同质量的N4和N2所含原子个数比为1:2 D. N4是N2的同素异形体
2. 下列物质中,既能与氨气反应,又能与二氧化碳反应的是
A. 水 B. 氧气 C. 溴化氢 D. 氢氧化钠
3. 下列说法正确的是
A. 在Na3PO4溶液中,其c (Na+)是c (PO43-)的3倍
B. pH为2的盐酸中,其c (H+)是pH为1的盐酸的2倍
C. 在0.1 mol/LBa(OH)2溶液和0.2 mol/L氨水中,其c (OH-)相等
D. 在25℃时,无论是酸性、碱性还是中性溶液中,其c (H)和c (OH)的乘积相等
4. CH3COOH溶液与NaOH溶液反应,若反应后溶液的pH为7,那么
A. CH3COOH与NaOH的质量相等 B. CH3COOH与NaOH的物质的量相等
C. CH3COOH过量 D. 两种反应物溶液的物质的量浓度相等
5. 分别除去下列各物质中的杂质,所用试剂错误的是
A. 除去MgCl2中混有的少量MgCO3,可用盐酸
B. 除去FeCl3溶液中混有的少量FeCl2,可用NaClO的溶液
C. 除去FeCl2溶液中混有的少量Cu2+,可用Fe粉
D. 除去铁粉中混有的少量铝粉,可用NaOH溶液
6. 将等物质的量的Mg和Al混合均匀,分成四等份,分别加到下列四种过量的溶液中,充分反应后,放出氢气最多的是
A. 3 mol/L的HCl溶液 B. 4 mol/L的HNO3溶液
C. 8 mol/L的NaOH溶液 D. 18 mol/L的H2SO4溶液
7. 下列说法正确的是
A. 含元素种类相同而结构不同的化合物互为同分异构体
B. 烷烃、烯烃中碳、氢两种元素的质量比均为定值
C. 甲烷与氯气的混合气体在光照下反应,生成的是一氯甲烷和氯化氢
D. 某有机物完全燃烧后生成二氧化碳和水,则该有机物中必定含有碳、氢两种元素
8. 10℃时,某化学反应A→C的反应速率V(A) = 0.1 mol·L-1·s-1,若温度每升高10℃,反应速率增加到原来的2倍,若要使V(A) = 0.8 mol·L-1·s-1,则反应温度应控制在
A. 30℃ B. 40℃ C. 50℃ D. 60℃
二、选择题(本题包括10小题,第9~16小题每小题4分,第17、18小题每小题5分,共42分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分)
9. 在一定体积pH = 12的Ba(OH)2溶液中,逐滴加入pH = 2的NaHSO4溶液,当溶液的pH 恰好为7时,则参加反应的Ba(OH)2溶液与NaHSO4溶液的体积比是
A.1∶9 B.1∶1 C.1∶2 D.1∶4
10. 下列用来表示物质变化的反应式中,正确的是
A.钢铁腐蚀时可能发生的正极反应:2H2O + O2 + 4e- = 4OH-
B.常温下,NaHCO3溶液显碱性:HCO3— + H2O ![]() CO32—+ H3O+
CO32—+ H3O+
C.氢氧化镁与稀硫酸反应: H+ + OH— = H2O
D.硫酸亚铁酸性溶液中加入过氧化氢:2Fe2+ + H2O2 + 2H+ = 2Fe3+ + 2H2O
11.关于小苏打水溶液的表述正确的是
A.存在的电离只有:HCO3— ![]() H+ +
CO32—,H2O
H+ +
CO32—,H2O ![]() H+ +
OH—
H+ +
OH—
B.HCO3—的电离程度小于HCO3—的水解程度
C.c (Na+) + c (H+)= c (HCO3—)+ c (CO32—)+ c (OH—)
D.c (Na+) = c (HCO3—)+ c (CO32—)+ c (H2CO3)
12.2004年美国圣路易斯大学科学家研制了一种新型的 乙醇电池(DEFC),它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 = 2CO2 +3H2O。电池示意图如下图。
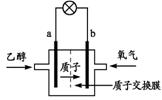
下列说法不正确的是
A. a极为电池的负极
B. 电池工作时电流由b极沿导线经灯泡再到a极
C. 电池正极的电极反应为:4H+ +O2 +4e- = 2H2O
D. 若有1 mol乙醇被氧化,则转移的电子为6 mol
13.下列各组离子一定能大量共存的是
A.在含大量Fe3+的溶液中:NH4+、Mg2+、Cl—、SCN—
B.在强碱溶液中:Na+、K+、AlO2—、CO32—
C.在c (H+) =10—13 mol/L 的溶液中:NH4+、Al3+、SO42—、NO3—
D.pH=13的溶液中:Cu2+ 、K+、NO-3、Cl-
14. 设NA表示阿伏加德罗常数的值,下列叙述中正确的是
A. 1 L 1 mol·L-1的盐酸溶液中,所含氯化氢分子数为NA
B. 标准状况下,11.2 L四氯化碳所含分子数为0.5NA
C. 1 mol CnH2n+2含有(3n+1)NA个共价键
D. 其他条件不变时,将1 mol NO2气体进行加压,加压后气体的分子数将少于NA个
15.某金属元素M的常见化合价有+4和+6,其与氮、氧元素组成的化合物MO2(NO3)2受热可发生的分解反应为:
MO2(NO3)2—— MXOY + NO2↑+ O2↑
在600 K 时,将气体产物收集于试管中并倒扣于水中,气体全部被吸收、水充满试管。则生成的M的氧化物的化学式是
A.MO3 B.MO2 C.MO2·2MO3 D.2MO2·MO3
16.下列各图象中,横坐标为向某溶液中加(通)入某反应物的物质的量,纵坐标为沉淀物的量,则下列叙述中错误的是
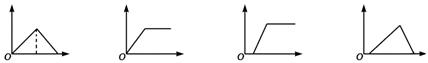
A B C D
A. 向氯化铝溶液中加入过量的氨水,其图像是B
B. 向饱和石灰水中通入过量的CO2气体,其图像是A
C. 向MgCl2、AlCl3的混合液中逐滴加入NaOH溶液至过量,其图像是D
D. 向含少量NaOH的偏铝酸钠溶液中通入过量的CO2气体,或向其中逐滴加入稀盐酸,其图像都是C
17.T °C时气体A与气体B在某容器中反应生成气体C和固体D,每1 mol A与足量B完全反应时生成1 mol D,反应过程中A、B、C浓度变化如图①所示。若保持其他条件不变,温度分别为T1和T2时,B的体积百分含量与时间的关系如图②所示。
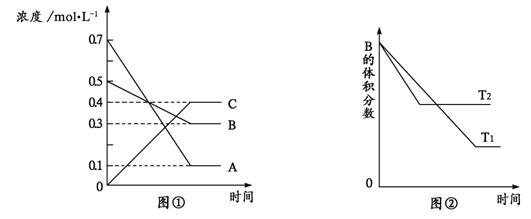
则下列结论正确的是
A.该反应的化学方程式是 A+3B![]() 2C+D
2C+D
B.T°C时,保持容器体积不变,若向上述平衡体系中加入0.2 mol C,则重新达平衡时B的浓度小于0.3 mol/L
C.其它条件不变,升高温度时,正、逆反应速率均增大,且A的转化率减小
D.相同时间内,消耗0.3 mol/L A时,生成了0.1 mol/L B,则反应达到平衡
18. 将60 mL甲烷和乙烷的混合气体与210 mL氧气混合,点火燃烧,将反应后的混合物通过浓硫酸充分吸收后,得剩余气体130 mL(气体体积均在同温同压下测定),则下列叙述中正确的是
A.所得130 mL剩余气体中是CO、CO2的混合物
B.所得130 mL剩余气体的平均相对分子质量是30
C.60 mL混合气体含甲烷为20 mL
D.根据题给条件无法求出60 mL混合气体中甲烷或乙烷的体积
徐州市2005——2006学年度年第一学期期末考试
高二化学试题(必修加选修)
| 题号 | 三 | 四 | 五 | 总分 |
| 得分 |
第二卷 (非选择题 共76分)
注意事项:
l.用钢笔或圆珠笔(除题目有特殊规定外)直接答在试卷上。
2.答卷前将密封线内的项目填写清楚。
| 得分 | 评卷人 |
三、(本题包括3小题,共26分)
19.(4分)下列实验操作或对实验事实的叙述正确的是_____________(填序号)。
①为了测定一包白色粉末的质量,用托盘天平称量时将药品放在左盘,砝码放在右盘,并移动游码使之平衡即可
②实验室制氨气时,选用无水CaCl2做干燥剂
③仅用蒸馏水和pH试纸作试剂,就可以鉴别pH相等的H2SO4溶液和CH3COOH溶液
④进行镁跟二氧化碳反应的实验时,将点燃的镁条放入盛有二氧化碳的集气瓶(瓶底部要放一些细沙)里即可
⑤为提高高锰酸钾溶液的氧化能力,用盐酸将KMnO4溶液酸化
⑥用水或硝酸银溶液都可以将溴蒸气和二氧化氮气体区别开来
20.(10分)实验室有一瓶混有氯化钠的氢氧化钠固体试剂,为了测定其纯度,用浓度为0.1152mol/L的盐酸标准溶液进行滴定。试回答下列问题:
(1)托盘天平称量3.2 g固体试剂,再用蒸馏水在烧杯中充分溶解并冷却至室温后,用玻璃棒引流转入500 mL容量瓶中,恰好至刻度线,振荡、摇匀即配成待测液备用。请指出以上操作中出现的错误有(多写倒扣分)
。
(2)将标准盐酸装在50.00 mL (填“酸式”或“碱式”)滴定管中,调节液面位置使其在 处,并记下刻度。
(3)取25.00 mL待测液并加入指示剂待测定。该项实验操作需要的主要仪器有
。
(4) 下列实验操作中,会引起测定结果偏低的(填字母) 。
A.转移待测液至容量瓶时,末洗涤烧杯
B.酸式滴定管用蒸馏水洗涤后,直接装盐酸
C.滴定时,反应容器摇动太激烈,有少量液体溅出
D.滴定到终点时,滴定管尖嘴悬有液滴
(5) 某同学所得实验数据如下表所示,据此,请写出上述固体试剂中NaOH的质量分数的计算式(不要化简) 。
| 实验编号 | 盐酸的浓度/ mol·L-1 | 滴定完成时,盐 酸滴入的体积/mL | 待测NaOH溶液 的体积/mL |
| 1 | 0.1152 | 26.72 | 25.00 |
| 2 | 0.1152 | 28.02 | 25.00 |
| 3 | 0.1152 | 26.70 | 25.00 |
21.(12分)某校化学小组学生利用下图所列装置进行“铁与水反应”的实验,并利用产物进一步还原氧化铜和制取FeCl3·6H2O晶体(图中夹持及尾气处理装置均已略去)。
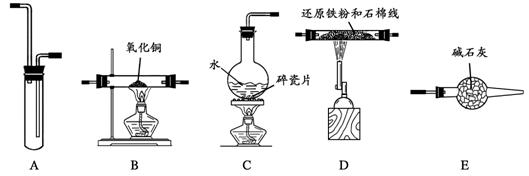
(1)实验时,按气体从左到右的流向,装置的连接顺序是(填大字母编号):C接
______________________接B。
(2)装置A的作用是 。C中碎瓷片的作用是 。E的作用是 。
(3)B中的现象是_____________________________________ __。
(4)为了安全,在B管中的反应发生前,在气体的最后出口处必须
;B管中的反应开始后,在气体的最后出口处应
。
(5)待反应完成、D管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。取滤液制取FeCl3·6H2O晶体,设计流程如下:

从滤液中得到FeCl3·6H2O晶体的主要操作包括:
_____________________________________________________________________。
| 得分 | 评卷人 |
四、(本题包括3小题,共29分)
22.(13分)完成下列反应的化学方程式(有机物写结构简式),是离子反应的只写出离子方程式。
⑴实验室用新制的消石灰和氯化铵反应制取氨气
______________________________________________________________。
⑵碳酸氢钠溶液与硫酸铝溶液混合反应
______________________________________________________________。
⑶新制的氢氧化亚铁悬浊液露置在空气中
______________________________________________________________。
⑷实验室制取乙烯
。
⑸丙烯在一定条件下生成聚丙烯
______________________________________________________________。
(6)配平下列氧化还原反应方程式:
FeSO4 + HIO3 + = Fe2(SO4)3 + I2 + H2O
23.(6分)(1)已知浓度均为0.1 mol/L的8种溶液:①CH3COONa、②KCl、③NH4Cl 、④NaOH 、⑤Ba(OH)2、⑥HNO3、⑦H2SO4、⑧CH3COOH,其溶液的pH由小到大的顺序是______________ (填写序号)。
(2)25℃时,若体积为Va、pH=a的某一元强酸溶液与体积为Vb、pH=b的某一元强碱溶液混合,恰好中和。请回答:
若a+b=12,则Va: Vb= 。
若Va<Vb和a=0.5b,则a的取值范围是_________________。
24. (10分)已知下图中(部分反应物或生成物没有列出),A、C既是工业上用途很广的两种重要化工原料,又是重要的化工产品;B是中学化学中常见的金属;M是一种重要化石燃料的主要成分;K是一种较好的耐火材料。M、H是正四面体结构的非极性分子,G、I均是气体,L是固体。
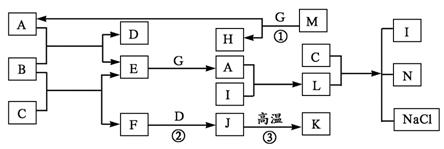
请按要求回答:
(1)写出B的化学式 ,N的电子式 ,L分子中含有的化学键的类型 。
(2)反应①进行的条件是 。
(3)反应②的离子方程式为 。
| 得分 | 评卷人 |
五、(本题包括2小题,共21分)
25.(9分)Cu跟2.00 L 1.00 mol/L 的硝酸反应,如果溶液中NO3-的物质的量浓度下降0.200 mol/L。试计算:
⑴溶液中H+的物质的量浓度下降多少?
⑵反应产生的气体在标准状况下的体积是多少?若将此气体收集在烧瓶中后,再将烧瓶倒立于水中并向瓶中通入氧气,当液体充满烧瓶时,通入氧气的体积是多少(标准状况)?
26.(12分)现有AlCl3和FeCl3混合溶液,其中Al3+和Fe3+的物质的量之和为0.1 mol,在此溶液中加入80 mL 浓度为4 mol/L的NaOH溶液,使其充分反应,设Al3+的物质的量与总物质的量的比值为x。
(1)根据反应的化学方程式计算,当x=0.5 时,溶液中产生的沉淀及其物质的量是
。
(2)当沉淀中只有Fe(OH)3时,x的取值范围是 ,请在下图中画出沉淀总量(mol)随x(0→1.0)变化的曲线。
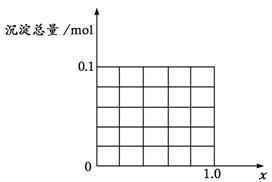
(3)若Al3+和Fe3+的物质的量之和为 n mol ( n为合理取值),其他条件不变,当沉淀中同时有Fe(OH)3、Al(OH)3时,x的取值范围是(用含有n、x的式子表示)
。
徐州市2005——2006学年度年第一学期期末考试
高二化学试题(必修加选修)参考答案和评分标准
说明:学生解答主观性试题时,使用与本答案不同的其他合理答案的也给分。
一、共32分。每小题4分。
1. D 2. A 3. D 4. C 5. B 6. A 7. D 8. B
二、共42分。第9~16小题每小题4分,第17、18小题每小题5分。每小题有一个或两个选项符合题意。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的给2分,选两个且都正确的给满分,但只要选错一个,该小题就为0分。
9. B 10. AD 11. BD 12. D 13. B 14. CD 15. A 16.CD 17.CD 18. C
三、共26分。第19题4分。第20题10分,每空2分。第21题12分;第(2)、(5)题各3分,其余每小题各2分。
19.③④⑥
20.(1)烧杯未洗涤,未用胶头滴管滴加蒸馏水至刻度线(或未定容)
(2)酸式 “0”或“0” 以下的某一刻度
(3)碱式滴定管、锥形瓶
(4)AC
(5)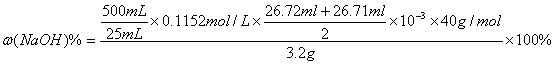
21.(1)D接A接E
(2)缓冲、冷凝 防止暴沸 干燥生成的氢气
(3)黑色固体变红色,并在管的后部有水珠(或水雾)出现
(4)检验氢气的纯度 点燃氢气
(5)加热浓缩、冷却结晶、过滤
四、共29分。第22题13分,第(6)题3分,其余每小题2分。第23题6分,每空2分。第24题10分,每小题2分。
22.略
23.(1)⑦⑥⑧③②①④⑤
(2)1:100 ![]() <a<
<a<![]()
24.(1)Al,![]() ,离子键和共价键
,离子键和共价键
(2)光照和过量的氯气
(3)3AlO2— + Al3+ +6H2O = 4Al(OH)3↓
五、共21分。第25题9分,每问3分。第26题12分,每小题4分。
25.(1)0.8 mol/L
(2) 8.96 L 6.72 L
26.(1)0.05 mol Fe(OH)3、0.03 mol Al(OH)3]
(2)0 ≤ x ≤ 0.2
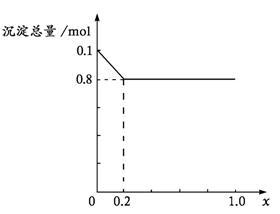
(3)![]() -3 ≤ x ≤1.0
-3 ≤ x ≤1.0