高二年级化学教学质量检测
化学试题卷 (理科)
考生须知:
1.本试卷分试题卷和答题卷,满分100分,考试时间90分钟。
2.答题前,在答题卷密封区内填写学校、班级和姓名。
3.所有答案必须写在答题卷上,写在试卷上无效。
4.考试结束,只需上交答题卷。
可能用到的相对原子质量: O16 C 12 H 1
一、选择题(每小题只有一个选项符合题意,每小题2分,共40分)
1.下列有关化学用语或名称,表达错误的是
![]() A.COCl2分子的结构式:Cl—
A.COCl2分子的结构式:Cl—![]() —Cl B.苯分子的比例模型:
—Cl B.苯分子的比例模型:
C.NaOH的电子式:Na+![]() D.
的名称:2—乙基丁烷
D.
的名称:2—乙基丁烷
2.化学反应中通常伴随着能量变化,下列说法中错误的是
A.煤燃烧时将部分化学能转化为热能
B.电解熔融Al2O3时将部分化学能转化为电能
C.TNT爆炸时将部分化学能转化为动能
D.镁条燃烧时将部分化学能转化为光能
3.下列关于有机反应化学方程式的认识中正确的是
A.从反应方程式可判断反应的类型
B.从反应方程式可推出反应机理
C.从反应方程式可判断中间产物
D.从反应方程式中可判断反应的难易程度
4.检验牙膏中是否含有甘油选用的试剂是
A.氢氧化钠溶液 B.氢氧化铜浊液 C.醋酸溶液 D.碳酸钠溶液
5.以下是“海带中碘元素的分离及检验”实验过程中某个环节中的实验步骤,其中正确的是
A.将干海带用蒸馏水泡发
B.将海带灰用蒸馏水浸泡,取其浸取液,向其中加入四氯化碳
C.向海带灰的浸取液中,加入少量稀硫酸和过氧化氢溶液
D.将海带灰的浸取液加入分液漏斗中进行分液分离
6.纸层析法分离铁离子和铜离子的实验中,正确的操作是
A.在滤纸上点样时,试样点以稍大为宜
B.应沿试管壁小心地将展开剂慢慢倒入试管底部
C.将滤纸上的试样点浸入展开剂中
D.点样后的滤纸需晾干后,才能将其浸入展开剂中
7.要确定乙酸乙酯与H218O反应后18O在乙酸中,可采取的方法是
A.用所得乙酸与大理石反应 B.测定产物中乙酸的物质的量
C.测定产物乙酸的相对分子质量 D.试验乙酸能否再与乙醇发生酯化反应
8.高温下,炽热的铁与水蒸气在一个体积可变的密闭容器中进行反应:
3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是
Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是
A.增加铁的量 B.将容器的体积缩小一半
C.压强不变,充入氮气使容器体积增大 D.加入催化剂
9.下列物质属于同系物的是
A.CH3CH2CH2OH与CH3OH B.![]() OH与
OH与![]() CH2OH
CH2OH
C.乙酸与HCOOCH3 D.CH3CH2Cl与CH3CH2CH2Br
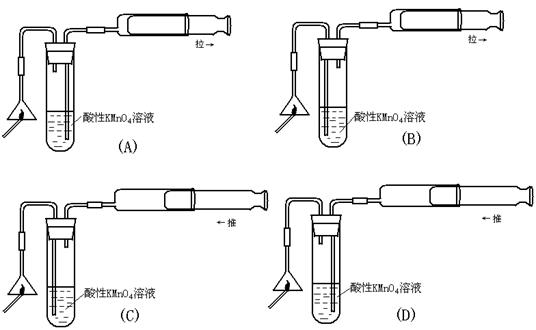
10.用于检验火柴头燃烧可产生SO2的装置正确的是
11.亚硝酸钠又称为“工业盐”,在新闻报道中常出现因误食工业盐而导致中毒的事件,下列关于亚硝酸钠的叙述不正确的是
A.亚硝酸钠外观与食盐相似
B.亚硝酸钠和食盐一样也具有咸味
C.食盐可用作食品的添加剂而亚硝酸钠绝对不可用作食品添加剂
D.亚硝酸钠溶液和食盐溶液中滴加硝酸银溶液均可产生白色沉淀
12.下列铜-锌原电池装置中,电极材料、灯泡、烧杯等均相同,能使小灯泡最亮且持续时间最长的是

 13.如右图所示,比较不同浓度的硫代硫酸钠溶液和同浓度的硫酸反应的速率大小的实验中,锥形瓶瓶底衬有画了“十”字的白纸,先向瓶内加入硫代硫酸钠溶液,再加入硫酸溶液。需记录反应所需的时间,正确的记时方法是
13.如右图所示,比较不同浓度的硫代硫酸钠溶液和同浓度的硫酸反应的速率大小的实验中,锥形瓶瓶底衬有画了“十”字的白纸,先向瓶内加入硫代硫酸钠溶液,再加入硫酸溶液。需记录反应所需的时间,正确的记时方法是
A.加入硫代硫酸钠溶液后即开始记时,瓶中出现浑浊现象时记时结束
B.加入硫代硫酸钠酸溶液后即开始记时,加入硫酸溶液后记时结束
C.加入硫酸溶液后即开始记时,瓶中出现浑浊现象记时结束
D.加入硫酸溶液后即开始记时,至看不到瓶底“十”字记时结束
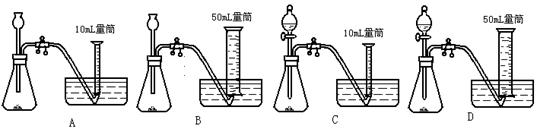
14.比较MnO2和CuO对H2O2分解反应的催化能力大小的实验中若催化剂的质量均控制在0.1g,6%的H2O2溶液均取5 mL,可选择的实验装置是
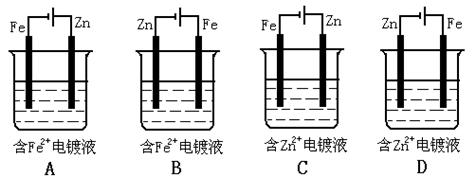
15.下列装置,可达到铁片上镀锌目的的是
16.有相同的三块铝片,进行如下实验
实验一:取第一块铝片,直接放入硫酸铜溶液中观察现象
实验二:取第二块铝片,用砂纸擦试表面后,放入硫酸铜溶液中观察现象
实验三:将实验一中铝片从硫酸铜溶液中取出,洗净后放入氢氧化钠溶液中,片刻后取出铝片,洗净后再放入硫酸铜溶液中观察现象
实验四:取第三块铝片,用砂纸擦试表面后,置于浓硝酸中,片刻后取出,洗净,再放入硫酸铜溶液中观察现象
综合以上四个实验的主要目的是试图说明
A.铝片能和硫酸铜溶液反应 B.铝片能和氢氧化钠溶液反应
C.铝片不能和硝酸反应 D.铝片表面能形成具有保护作用的氧化膜
17.某烃室温时为气态,完全燃烧后,生成的H2O和CO2的物质的量之比为3∶4。只含有一个官能团的链烃的同分异构体的数目有
A.2 B.3 C.4 D.5
18.将0.l mol∙L-1的下列物质的水溶液,从常温加热到80℃,溶液的pH不变的是
A.NaCl B. NaOH C.H2SO4 D. NH4Cl
19.25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是
A.c(NH4+)=c(SO42-) B.c(NH4+)>c(SO42-)
C.c(NH4+)<c(SO42-)
D.c(OH-)+c(SO42-)=c(H+)+(NH4+)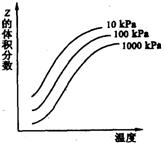
20.右图是温度和压强对X+Y![]() 2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
A.上述可逆反应的正反应为放热反应
B.X、Y、Z均为气态
C.X和Y中只有一种为气态,Z为气态
D.上述反应的逆反应的ΔH>0
二、简答题(本大题共6小题,共38分)
21.(8分)某反应的热化学方程式为:2AB3(g)![]() A2(g)+3B2(g)
△H= +92.4kJ·mol–1 请根据该式回答下列问题:
A2(g)+3B2(g)
△H= +92.4kJ·mol–1 请根据该式回答下列问题:
(1)该反应是 ▲ (选填“放”或“吸”)热反应,从物质本身所含的能量角度看, ▲ > ▲ ;从键能的角度看 ▲ > ▲ 。
(2)若在实际生产中消耗1 mol B2物质,则反应中 ▲ (填写“放出”或“吸收”)的热量为 ▲ kJ。
22.(10分)回答下列有关常数的问题
(1)Kw的数学表达式是Kw= ▲ ,温度升高Kw的变化情况是 ▲ (选填“变大”、“变小”或“不变”),若定义pOH=-lgc(OH-),则pH+pOH= ▲ (用含Kw的代数式表示)
(2)K通常表示化学平衡常数,K值越大表示该反应进行得越 ▲ ,对于反应2NO2(g)![]() N2O4(g),其化学平衡常K的数学表达式为
N2O4(g),其化学平衡常K的数学表达式为![]() ,式中c2(NO2)表示的意义是
▲ 。
,式中c2(NO2)表示的意义是
▲ 。
(3)Ka通常表示弱酸的电离平衡常数,Ka值越大表示该弱酸 ▲ ,α通常称为电离度,顾名思义是表示弱电解质的电离程度大小的一个指标,对于某一元弱酸,当用蒸馏水稀释该酸时,溶液越稀,Ka的变化情况是 ▲ (选填“变大”、“变小”或“不变”),α的变化情况是 ▲ (选填“变大”、“变小”或“不变”)。
(4)Ksp表示难溶物的溶度积常数,该常数越大表示 ▲ ,若在1 L蒸馏水中加入1滴(约0.05mL)0.1mol·L-1的NaCl溶液,搅拌均匀后再滴入1滴0.1 mol·L-1AgNO3溶液,请估算是否会产生沉淀? ▲ (已知AgCl的Ksp=1.8×10–10)
23.(5分)判断下列五种溶液的酸碱性,并填写下表:
| 溶液 | 用化学用语表示溶液呈酸性(或碱性)的原因 |
| Fe2(SO4)3溶液 | ▲ |
| NH4NO3溶液 | ▲ |
| Na2CO3溶液 | ▲ |
| NaHSO4溶液 | ▲ |
| 等物质量醋酸和醋酸钠的混合液 | ▲ |
24.(4分)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振谱表明分子内所有氢原子都处于相同的化学环境,由此推测
(1)A的结构简式为 ▲ ;
(2)A中的碳原子是否都处于同一平面? ▲ (填“是”或者“不是”);
25.(6分)2008年北京残奥会吉祥物是以牛为形象设计的“福牛乐乐”(Funiulele)。有一种有机物的键线式也酷似牛形(下图所示),故称为牛式二烯炔醇(cowenyenynol)。回答下列有关该物质的问题:
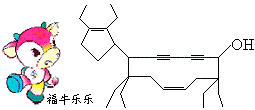
(1)“牛身”是由 ▲ 个碳原子形成的碳环。
(2)1 mol牛式二烯炔醇最多可跟 ▲ mol Br2发生加成反应。
(3)该物质能否在浓硫酸、加热的条件下发生消去反应? ▲
26.(5分)有下列六种基团:①苯基;②醛基;③羟基;④羧基;⑤乙基,⑥氯原子(-Cl)这六种基团两两结合,可形成新的化合物,写出符合下列条件的化合物的名称(不必写该物质的结构简式或化学式)
(1)分子内氧原子数不超过2个,具有酸性,但不能和碳酸氢钠反应。 ▲
(2)分子内氧原子数不超过2个,能发生银镜反应的物质,除苯甲醛和甲酰氯(Cl-CHO)外还有 ▲ 。
(3)不稳定的两元弱酸 ▲ 。
三、实验题(本大题共2小题,共12分)
27.(6分)下图所示为减压过滤装置,回答有关问题。
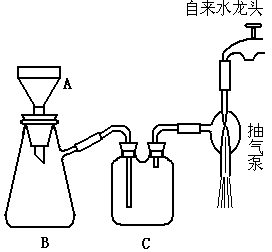
(1)写出图中A、B、C三种仪器的名称,A ▲ ;B ▲ ;C ▲ 。
(2)该装置图有三处错误,请指出错误并加以改正。① ▲ ;
② ▲ ;③ ▲ 。
28.有学生在实验室中向盛有10mL饱和氯化铁溶液的试管里投入足量铝片,观察到如下现象:
①黄色溶液很快变成红褐色,过一会儿溶液中有红褐色沉淀生成。
②铝片表面立刻有少量黑色物质析出,黑色物质能被磁铁吸起。
③混合液温度升高甚至发烫,产生无色气泡,且产生气泡速率明显加快,铝片上下翻滚。
(1)产生的红褐色沉淀是________▲______,无色气泡的成分是______▲_____。
(2)生成红褐色沉淀的原因是__________________▲___________。
(3)写出生成气泡速率明显加快的两个原因_____▲_______、______▲_______。
四、计算题(本大题共2小题,共10分)
29.现取有机物A 3.00g与4.48L(标准状况)氧气在密闭容器中燃烧,燃烧后产物只有二氧化碳、—氧化碳和水蒸气(没有反应物剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.60g,碱石灰增重4.40g。回答下列问题:
(1)3.00gA中所含氢原子为 ▲ mol、碳原子为 ▲ mol。
(2)该有机物的分子式为 ▲ 。
30.用25 mL移液管量取市售食醋25 mL,置于250mL容量瓶中,加水稀释至刻度,摇匀得到待测食醋溶液,用0.100 0 mol·L-1NaOH标准溶液滴定,滴定过程中记录如下数据:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 待测食醋的体积初读数/mL | 0.02 | 0.03 | 0.00 |
| 待测食醋的体积终读数/mL | 25.01 | 25.04 | 25.02 |
| 氢氧化钠标准液的体积初读数/mL | 0.01 | 0.03 | 0.04 |
| 氢氧化钠标准液的体积终读数/mL | 12.52 | 12.55 | 12.58 |
由以上数据可求得该市售食醋总酸含量的平均值为 ▲ (g/100mL)。(答案保留三位小数)