第一章 氮族元素单元测试
一、选择题(每题有1个正确答案。每题2分,共20分)
( )1、下列试剂中,必须用棕色试剂瓶盛装的有
①浓氨水 ②氯水 ③硝酸银 ④浓硝酸 ⑤浓盐酸 ⑥溴化银
A、①②③④⑤⑥ B、②③④⑥
C、②⑧⑤⑥ D、①⑧④⑥
( )2、农业及城市生活污水中含磷,家用洗涤剂就是污水中磷的一个重要来源(洗涤剂中含
有磷酸钠),处理污水时要不要除去磷,有以下几种意见,你认为正确的是
A、磷是生物的营养元素,不必除去
B、含磷的污水是很好的肥料,不必处理
C、含磷的污水排放于自然水中,能引起藻类增殖,使水变质,必须处理
D、磷对人无毒,除去与否都无关紧要
( )3、1.6gCu与50mL 的8mol·L-1 HNO3充分反应,硝酸的还原产物有NO和NO2,反应后混合溶液中H+浓度为a mol·L-1(生成水的体积忽略不计),则此时溶液中所含NO3-的物质的量为
A.(a+1)mol B.(0.4+0.5a)mol C.(a+0.05)mol D.0.05(a+1)mol
( )4、下列叙述不正确的是
A、鉴别NO2和Br2(蒸气),可用AgNO3溶液而不能用湿润的淀粉碘化钾试纸
B、检验磷酸是否电离出PO43-:向磷酸溶液中加入AgNO3溶液,观察是否出现黄色Ag3PO4沉淀
C、检验某试液中是否含有NH4+,可向该试液中加入NaOH溶液,加热,再将湿润的红色石蕊试纸置于试管口处,观察试纸是否变蓝色
D、检验某溶液中是否含有NO3-,可将溶液浓缩后再向溶液中加浓硫酸和铜片,加热,观察是否有红棕色气体产生
( )5、R2O8n-离子在一定条件下可以把Mn2+氧化为MnO4-,若反应后R2O8n-变为RO42-离子,反应中氧化剂与还原剂物质的量比为5:2,则n=
A、1 B、2 C、3 D、4
( )6、将黄铜(Cu、Zn合金)放入一定量的稀硝酸中,充分反应后,剩余金属m g,再向其中加入一定量的稀硫酸,充分振荡后,仍有n g金属剩余,则
A、m<n B、m>n C、m=n D、无法确定
( )7、工业上用CaO和HNO3为原料制备Ca(NO3)2·4H2O晶体。为确保制备过程中即不补充水也无多余的水分,所用硝酸溶液的质量分数应为
A、30% B、63% C、70% D、无法确定
( )8、红磷在Cl2燃烧时,参加反应的P与Cl2物质的量之比为1:1.8,则生成物中PCl5与PCl3物质的量之比为:
A、3:5 B、5:3 C、3:7 D、1:2
( )9、下列试剂敞口保存,一段时间后质量增加但不变质的是
A.硅酸钠溶液 B.浓硝酸 C.浓H2SO4 D.亚硫酸钠固体
( )10、同温同压下,两个等体积的干燥圆底烧瓶中分别充满两种气体:①HCl ②NO2倒置于盛有足量水的水槽中,经充分反应后,瓶内溶液的物质的量浓度是
A、①>② B、①<② C、①=② D、不能确定将
二、选择题(每题有1~2个正确答案。每题3分,共30分)
( )11、下列叙述正确的是
A、液态空气气化时,液氮首先气化,据此可分离出空气中的氮气
B、豆科作物根部有根瘤菌,能将空气中的氮气在常温常压下转化为氮的化合物,供作物吸收
C、磷单质的化学活泼性比氮气强,表明磷的非金属性比氮强
D、蘸有浓氨水的玻璃棒接近浓盐酸、浓硫酸、浓硝酸时都会产生白烟
( )12、下列离子反应方程式正确的是
A、 铜片溶于稀硝酸:3Cu+8H++2NO3-===3Cu2++2NO↑+4H2O
B、磷酸溶液中加入1:2的氢氧化钠溶液:H3PO4+2OH+=== HPO42-+2H2O
C、氮化镁固体溶于足量稀硫酸:Mg3N2+6H+===3Mg2++2NH3↑
D、氯气溶于冷水:Cl2+H2O===2H++Cl-+ClO-
( )13、将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,量筒中还剩余2mL无色气体,则原混合气体中O2的体积是
A、1.2mL B、2.4mL C、3.6mL D、4mL
( )14、16.8LCO2(STP)气体通入1.00moL·L-11.00L的KOH溶液中生成的CO32-与HCO3-物质的量之比为
A、3:2 B、2:3 C、2:1 D、1:2
( )15、关于磷的下列叙述中,正确的是
A、白磷没有毒而红磷剧毒 B、白磷在空气中加热到260℃可转变为红磷
C、白磷可用于制造安全火柴 D、少量白磷应保存在水中
( )16、对比下列两个反应:2F2+2H2O=== 4HF+O2↑ 4NH3+3O2=== 2N2+6H2O可以得到的结论是
A、H2O和NH3在氧化还原反应中只能作还原剂
B、上述两个反应均是置换反应
 C、氮的非金属性比氧弱,氧的非金属性比氟弱
C、氮的非金属性比氧弱,氧的非金属性比氟弱
D、按N、O、F的顺序非金属性依次减弱
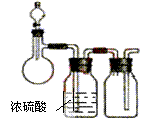
( )17、右图是制取、干燥和收集某气体的实验装置,可用于
A、用Zn与稀H2SO4反应制H2
B、用CaO与浓氨水反应制NH3
C、用Cu与稀HNO3反应制NO
D、用MnO2与H2O2反应制O2
( )18、下列各组离子在溶液中,因发生氧化还原反应而不能大量共存的是
A.K+、C1-、Ca2+、NO3— B.Ca2+、HPO2—、NO3—、Na+
C.H+、Fe2+、NO3—、Na+ D.NH4+、SO42—、K+、OH—
( )19、所有氮的氧化物都能和灼热的铁粉发生下列反应:4NxOy+3yFe=yFe3O4+2xN2。
将2mol NxOy通过500g灼热铁粉完全反应后,生成ImolN2和1mol Fe3O4,则使用的氮的氧化物是
A.N2O B. NO C.NO2 D.N2O3
( )20、下列反应中,气体反应物只作还原剂的是
A.二氧化氮被水吸收 B.NO和NO2同时被NaOH溶液吸收
C.镁条在N2中燃烧 D.一氧化氮与硝酸反应生成三氧化二氮和水
三、填空 (本题包括3小题。共34分)
21、(8分)(1)配平下列反应方程式:
( )KClO3+( )HCl==( )ClO2↑+( )Cl2↑+( )KCl+( )
(2)I2分子能与I-结合生成Ix-,Ix-在强碱性条件下被ClO-氧化为IO3-,试写出该反应的离子方程式 。若参加反应的ClO-与OH-的物质的量之比为4:1,则x=
22、(16分)下图中①~⑾分别代表有关反应中的一种物质,请填写以下空白。

(1)写出下列反应方程式:
③+④
⑧与⑨反应
②+Mg条(点燃)
②+Na2O2
③+CuO(加热)
(2)写出离子方程式:
⑤+⑧(少量)
⑧的稀溶液+Ag
N2+Mg条(点燃)生成的产物溶于足量稀盐酸
23、(10分)喷泉是一种常见自然现象,其产生原因是存在压强差。就此现象回答下列一些问题。
(1)图1为化学教学中所用的喷泉实验装置。在烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是( )
 A、HCl和H2O B、O2和H2O
A、HCl和H2O B、O2和H2O
C、NH3和H2O D、CO2和NaOH溶液
(2)某学生经过设计,得出了图2的喷泉实验装置,在锥形瓶中,分别加入足量的下列物质,反应后可能产生喷泉的是( )
A、Cu与稀盐酸 B、NaHCO3和NaOH溶液
C、CaCO3与稀硫酸 D、NH4HCO3与稀盐酸 图1
 (3)如果在图2锥形瓶外放一水槽,瓶中加入酒精,水槽中图2加入冰水 后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是( )
(3)如果在图2锥形瓶外放一水槽,瓶中加入酒精,水槽中图2加入冰水 后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质可以是( )
A、浓硫酸 B、食盐
C、硝酸钾 D、硫酸铜
(4)比较图1和图2两套装置,从产生喷泉的原理来分析,图1是 上部烧瓶内压强,图2是 下部锥形瓶内的气体压强(均填大或减小)。
(5)城市中常见的人造喷泉及火山爆发的原理与上述
(填图1或图2)装置的原理相似。 图2
四、计算(本题包括1小题。共18分)
24、(16分)制硫酸排放的尾气中,含少量的二氧化硫。为防止污染大气,在排放前设法进行综合利用。
(1)某硫酸厂每天排放的10000m3尾气(气体视为标况)中含0.2%(体积百分数)的SO2。问用氢氧化钠溶液、石灰及氧气处理后,假设硫元素不损失,理论上可得到多少kg石膏。(CaSO4·2H2O)
(2)如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含16.7g溶质。试分析该溶液的成份,并计算确定各成分的物质的量。
(3)工厂在尾气处理制石膏的过程中,中间产物是亚硫酸氢钠。调节尾气排放的流量,以取得二氧化硫与氢氧化钠间物质的量的最佳比值,从而提高亚硫酸氢钠的产量。现设
n(SO2)、n(NaOH)、n(NaHSO3)分别表示二氧化硫、氢氧化钠和亚硫酸氢钠的物质的量, 试写出X [ X表示n(SO2)/n(NaOH) ]在不同取值范围时,n(NaHSO3)的值或n(NaHSO3)与n(SO2)、n(NaOH)间的关系式。
x | n(NaHSO3) |
X=1/2 | 0 |
X>1 |